题目内容
研究NO2、SO2、CO等大气污染气体的处理具有重要意义。
(1)利用反应:6NO2+8NH3 7N2+12H2O可处理NO2。当转移1.2mol电子时,消耗的NO2在标准状况下的体积是 L。
7N2+12H2O可处理NO2。当转移1.2mol电子时,消耗的NO2在标准状况下的体积是 L。
(2)①已知:2SO2(g)+O2(g) 2SO3(g) ΔH=?196.6 kJ·mol–1
2SO3(g) ΔH=?196.6 kJ·mol–1
2NO(g)+O2(g) 2NO2(g) ΔH=?113.0 kJ·mol–1
2NO2(g) ΔH=?113.0 kJ·mol–1
请写出NO2与SO2反应生成SO3(g)和NO的热化学方程式 。
②一定条件下,将NO2与SO2以体积比1:2置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是 。
a.体系压强保持不变 b.混合气体颜色保持不变
c.SO3和NO的体积比保持不变 d.每消耗1 mol SO2的同时生成1 molNO2
③测得上述反应平衡时NO2与SO2体积比为1:6,则该反应的平衡常数K= 。
(3)汽车尾气中的一氧化碳可通过如下反应降低其浓度:CO(g)+1/2O2(g) CO2(g)。已知某温度下,在两个恒容密闭容器中进行该反应,容器中各物质的起始浓度及正、逆反应速率关系如下表所示。请用“>”或“<”或“=”填写表中的空格。
CO2(g)。已知某温度下,在两个恒容密闭容器中进行该反应,容器中各物质的起始浓度及正、逆反应速率关系如下表所示。请用“>”或“<”或“=”填写表中的空格。
| 容器编号 | c(CO)/mol·L–1 | c(O2)/mol·L–1 | c(CO2)/mol·L–1 | υ(正)和υ(逆) 大小比较 |
| ① | 2.0×10–4 | 4.0×10–4 | 4.0×10–4 | υ(正)=υ(逆) |
| ② | 1.0×10–3 | 4.0×10–4 | 5.0×10–4 | υ(正) υ(逆) |
(1)6.72L(2分)
(2)①NO2(g)+SO2(g) SO3(g)+NO(g) △H=-41.8kJ/mol(2分)②bd(2分)
SO3(g)+NO(g) △H=-41.8kJ/mol(2分)②bd(2分)
③ (2分) (3)>(2分)
(2分) (3)>(2分)
解析试题分析:(1)根据方程式6NO2+8NH3 7N2+12H2O可知,NO2中氮元素的化合价从+4价降低到0价,得到4个电子,所以当转移1.2mol电子时,消耗的NO2的物质的量是1.2mol÷4=0.3mol,则在标准状况下的体积是0.3mol×22.4L/mol=6.72L。
7N2+12H2O可知,NO2中氮元素的化合价从+4价降低到0价,得到4个电子,所以当转移1.2mol电子时,消耗的NO2的物质的量是1.2mol÷4=0.3mol,则在标准状况下的体积是0.3mol×22.4L/mol=6.72L。
(2)①已知反应①2SO2(g)+O2(g) 2SO3(g) ΔH=?196.6 kJ·mol–1,②2NO(g)+O2(g)
2SO3(g) ΔH=?196.6 kJ·mol–1,②2NO(g)+O2(g) 2NO2(g) ΔH=?113.0 kJ·mol–1,则根据盖斯定律可知(①-②)÷2即得到反应NO2(g)+SO2(g)
2NO2(g) ΔH=?113.0 kJ·mol–1,则根据盖斯定律可知(①-②)÷2即得到反应NO2(g)+SO2(g) SO3(g)+NO(g),所以该反应的反应热△H=(?196.6 kJ/mol+113.0 kJ/mol)÷2=-41.8kJ/mol。
SO3(g)+NO(g),所以该反应的反应热△H=(?196.6 kJ/mol+113.0 kJ/mol)÷2=-41.8kJ/mol。
②在一定条件下,当可逆反应的正反应速率和逆反应速率相等时(但不为0),反应体系中各种物质的浓度或含量不再发生变化的状态,称为化学平衡状态,据此可以解答。a、该反应前后体积不变,因此压强始终是不变的,即体系压强保持不变不能说明反应达到平衡状态,a不正确;b、颜色的深浅与物质的浓度有关系,所以混合气体颜色保持不变,说明NO2的浓度不再发生变化,因此反应达到平衡状态,b正确;C、SO3和NO是生成物,二者的体积比之比始终是1:1,所以SO3和NO的体积比保持不变不能说明反应达到平衡状态,c不正确;d、每消耗1 mol SO2的同时必然同时消耗1molNO2,而同时又生成1 molNO2,这说明正逆反应速率相等,反应达到平衡状态,d正确,答案选bd。
③ NO2(g)+SO2(g) SO3(g)+NO(g)
SO3(g)+NO(g)
起始量(mol) 1 2 0 0
转化量(mol) x x x x
平衡量(mol) 1-x 2-x x x
测得上述反应平衡时NO2与SO2体积比为1:6
则(1-x):( 2-x)=1:6
解得x=0.8
由于反应前后体积不变,所以可以用物质的量代替浓度表示平衡常数
该反应的平衡常数K=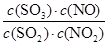 =
=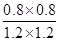 =
= 。
。
(3)容器①中υ(正)=υ(逆),说明反应达到平衡状态,则该反应的平衡常数K=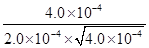 =100。根据容器②中物质的浓度可知,此时
=100。根据容器②中物质的浓度可知,此时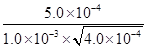 =25<100,所以反应向正反应方向进行,则υ(正)>υ(逆)。
=25<100,所以反应向正反应方向进行,则υ(正)>υ(逆)。
考点:考查氧化还原反应的计算、热化学方程式书写、平衡状态判断以及平衡常数计算与应用

 步步高达标卷系列答案
步步高达标卷系列答案利用废旧镀锌铁皮可制备磁性Fe3O4胶体粒子及副产物ZnO。制备流程图如下: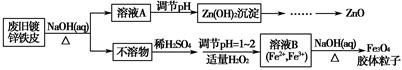
已知:Zn及其化合物的性质与Al及其化合物的性质相似。请回答下列问题:
(1)用NaOH溶液处理废旧镀锌铁皮的作用有________。
| A.去除油污 | B.溶解镀锌层 | C.去除铁锈 | D.钝化 |
(3)由溶液B制得Fe3O4胶体粒子的过程中,须持续通入N2,其原因是_________________________________________________________。
(4)用重铬酸钾法(一种氧化还原滴定法)可测定产物Fe3O4中的二价铁含量。若需配制浓度为0.010 00 mol·L-1的K2Cr2O7标准溶液250 mL,应准确称取________g K2Cr2O7(保留4位有效数字,已知MK2Cr2O7=294.0 g·mol-1)。配制该标准溶液时,下列仪器中不必要用到的有________(用编号表示)。
①电子天平;②烧杯;③量筒;④玻璃棒;⑤容量瓶;⑥胶头滴管;⑦移液管
(5)滴定操作中,如果滴定前装有K2Cr2O7标准溶液的滴定管尖嘴部分有气泡,而滴定结束后气泡消失,则测定结果将________(填“偏大”“偏小”或“不变”)。


 CH3OH(g) +H2O(g) △H
CH3OH(g) +H2O(g) △H 
 _____Cu+_____CuCl2+N2↑+_____H2O。
_____Cu+_____CuCl2+N2↑+_____H2O。