题目内容
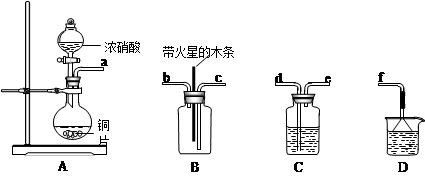
(1)配平该反应并标出电子转移的方向和数目:KMnO4+HCl = MnCl2+ KCl+ Cl2↑+ H2O
(2)氧化剂是________________,氧化产物是__________________(填化学式)。
(3)若生成71 g Cl2消耗的HCl是___________________,被氧化的HCl是_______________。
(4)CS2(液体)能在O2中完全燃烧,生成CO2和SO2,若将0.1 mol CS2在1 mol O2中完全燃烧,所得混合气体在标准状况下所占的体积为__________L。
Ⅱ、(6分)(1)下列A. B. C. D 是中学常见的混合物分离或提纯的基本装置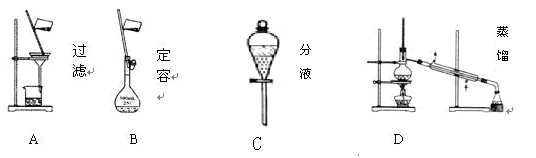
请根据实验需要将A. B.C. D装置填入适当的空格中。
①分离汽油和氯化钠溶液____________________
②用自来水制取蒸馏水__________________
③除去粗盐溶液中悬浮的泥沙_______________________________
(2)检验Fe3+常用的试剂除碱外,还可以将KSCN溶液滴入待检测溶液中,其产生的现象是______
________________________,发生反应的离子方程式________________________________。
(1)2KMnO4+16HCl =2MnCl2+2KCl+5Cl2↑+8H2O(4分,单双线桥均可)
(2)KMnO4,Cl2(每空1分,填化学式才给分)
(3)3.2 mol,2 mol。(每空1分,不带单位不给分)
(4)22.4 (2分)
Ⅱ.(6分)
(1)① C(1分) ② D(1分) ③A (1分)
(2)溶液变为血红色,(1分) Fe3+ + 3SCN- =" Fe" (SCN)3(2分)
解析试题分析:Ⅰ(1)锰由正7价还原为正2价,氯由负1价氧化为0价。
(2)氧化剂得到电子被还原,还原剂失去电子被氧化。
(3)71g氯气是1mol,根据化学方程式可知,消耗的氯气是3.2 mol,被氧化的氯气是2 mol。
(4)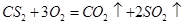 ,反应前后气体的体积不变。
,反应前后气体的体积不变。
Ⅱ(1)①汽油和氯化钠不相容用分液;②蒸馏使水先变成蒸汽再冷凝成水,除去杂质;③过滤是指在推动力或者其他外力作用下悬浮液(或含固体颗粒发热气体)中的液体(或气体)透过介质,固体颗粒及其他物质被过滤介质截留,从而使固体及其他物质与液体(或气体)分离的操作;
(2)生成了络合物。
考点:氧化还原反应和试验操作。

 CH3OH(g) +H2O(g) △H
CH3OH(g) +H2O(g) △H