题目内容
【题目】质量守恒定律的定量研究对化学科学发展具有重大意义。
(1)下图为某化学反应的微观模拟图,“○”和“![]() ”分别表示两种不同的原子:
”分别表示两种不同的原子:
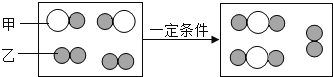
由微粒甲“![]() ”聚集成的物质______(填“可能”或“不可能”)是氧化物,参加反应的甲、乙两种反应物分子的个数比为______,此反应的基本反应类型为______,任举一例符合此反应类型的化学方程式______。
”聚集成的物质______(填“可能”或“不可能”)是氧化物,参加反应的甲、乙两种反应物分子的个数比为______,此反应的基本反应类型为______,任举一例符合此反应类型的化学方程式______。
(2)把m1g镁带放在空气中完全燃烧,通过计算可知,生成氧化镁m2g(只考虑与氧气的反应,下同),则m1______m2(填大于或小于或等于)。小嘉同学在做该实验时,观察到耀眼的白光,冒出大量白烟,称量无误时,发现m1>m2,其原因可能是______。
【答案】 可能 1:2(或2:1) 化合反应 2CO+O2![]() 2CO2 小于 生成物氧化镁部分以白烟的形式逸散(或扩散)到空气中
2CO2 小于 生成物氧化镁部分以白烟的形式逸散(或扩散)到空气中
【解析】(1)“![]() ”和“
”和“![]() ”分别表示两种不同的原子,则微粒甲“
”分别表示两种不同的原子,则微粒甲“![]() ”聚集成的物质由两种元素组成,可能一种为氧元素,所以微粒甲可能为氧化物;由转化关系图可得,每1个反应物分子和2个另一种反应物分子反应,两种反应物分子个数比为1:2(或2:1);该反应的反应物是两种,生成物是一种,属于化合反应;符合此反应类型的化学方程式可以是:2CO+O2
”聚集成的物质由两种元素组成,可能一种为氧元素,所以微粒甲可能为氧化物;由转化关系图可得,每1个反应物分子和2个另一种反应物分子反应,两种反应物分子个数比为1:2(或2:1);该反应的反应物是两种,生成物是一种,属于化合反应;符合此反应类型的化学方程式可以是:2CO+O2![]() 2CO2。
2CO2。
(2)根据质量守恒定律,参加反应的镁的质量+氧气的质量=生成氧化镁的质量,所以m1小于m2;镁燃烧时发出耀眼的白光,放出大量的热,产生大量白烟,此白烟就是生成的氧化镁固体小颗粒,白烟有很大一部分向上,逸散(或扩散)到空气中去了,所以称量时会得出m1>m2的结果。

练习册系列答案
相关题目