题目内容
【题目】钛被称为继铁、铝之后的第三金属,其单质及化合物在航天、军事、航海、医疔等领域都有着重要的应用。请回答下列问题:
(1)基态Ti原子的价电子轨道表示式为___________。
(2)化学式为[Ti(H2O)6]Cl3的绿色晶体是TiCl3的六水合物的一种晶型,该晶体中,与Ti3+形成配位键的原子是___________ (填元素符号),该原子的杂化类型为___________杂化,该晶体所含元素中,电负性最大的元素是___________ (填元素符号)。
(3)化学式为[Ti(H2O)5 Cl]Cl2·H2O的绿色晶体是TiCl3的六水合物的另一种晶型,取1mol该晶体溶于水配成500mL溶液,加入足量AgNO3溶液使Cl-完全沉淀,消耗AgNO3的物质的量为___________mol。
(4)钛与卤素形成的化合物的熔沸点如下表所示,
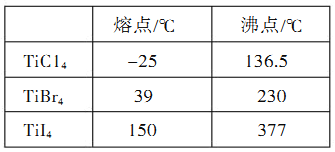
TiCl4、TiBr4、TiI4的熔点和沸点呈现一定变化规律的原因是______________________。
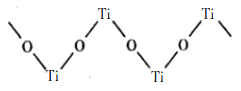
(5)TiO2能溶浓硫酸并析出一种离子晶体,已知其中阳离子是以链状聚合物形式存在的钛酰阳离子,其结构如下图所示,阳离子化学式为___________,写出一种与SO42-互为等电子体的分子___________。
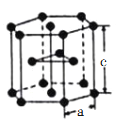
(6)下图是钛晶体在空间的一种堆积方式,此堆积方式名称为___________,钛原子的配位数为__________。已知:a=0.295nm,c=0.469nm,则该钛晶体的密度为___________g·cm-3(NA表示阿伏加德罗常数的值,列出计算式即可)。
【答案】![]() O sp3 O 2 TiCl4、TiBr4、TiI4都是分子晶体,而且组成和结构相似,其相对分子质量依次增大,分子间作用力逐渐增大,因而三者的熔点和沸点依次升高 (TiO)n2n+ 或(TiO2+) CCl4 SiCl4等 六方最密堆积 12 48×6/[
O sp3 O 2 TiCl4、TiBr4、TiI4都是分子晶体,而且组成和结构相似,其相对分子质量依次增大,分子间作用力逐渐增大,因而三者的熔点和沸点依次升高 (TiO)n2n+ 或(TiO2+) CCl4 SiCl4等 六方最密堆积 12 48×6/[![]() ×(2.95×10-8)2×4.69×10-8NA]
×(2.95×10-8)2×4.69×10-8NA]
【解析】
(1)根据基态Ti原子的价电子为3d24s2,画出其价电子轨道表示式;
(2) [Ti(H2O)6]Cl3晶体中,与Ti3+形成配位键的原子是O,O原子的杂化类型为sp3;晶体所含元素中,电负性最大的元素是O。
(3)取1mol绿色晶体[Ti(H2O)5Cl]Cl2·H2O溶于水配成500mL溶液,溶液中含有2mol氯离子,据此进行计算;
(4)组成和结构相似的分子晶体,其相对分子质量依次增大,分子间作用力逐渐增大,熔沸点越高;
(5) Ti与O的个数比为1:1,化学式为(TiO)n2n+ (TiO2+);SO42-中的S属于sp3杂化,SO42-原子总数为5,价层电子总数为32,据此规律写出与其互为等电子体的分子;
(6)由钛为六方最密堆积,钛原子的配位数为12;该结构中含有的钛原子个数为6个,质量为48×6/NAg;求出该结构的体积Vcm3;根据公式ρ=m/V计算出该晶体的密度。
(1)钛原子的核电荷数为22,其基态原子核外电子排布为:1s22S22p63s23p63d24s2,其价电子为3d24s2,价电子轨道表示式为![]() ;
;
综上所述,本题答案是:![]() 。
。
(2)化学式为[Ti(H2O)6]Cl3的绿色晶体是TiCl3的六水合物的一种晶型,该晶体中,与Ti3+形成配位键的原子是O,O原子形成2个σ键和2对孤电子对,该原子的杂化类型为sp3;同一周期,从左到右,电负性增大,同一主族,从上到下,电负性减小,因此该晶体所含元素中,电负性最大的元素是O。
综上所述,本题答案是:O,sp3 ,O。
(3)化学式为[Ti(H2O)5Cl]Cl2·H2O的绿色晶体是TiCl3的六水合物的另一种晶型,取1mol绿色晶体溶于水配成500mL溶液,溶液中含有2mol氯离子,加入足量AgNO3使Cl-完全沉淀,消耗AgNO3的物质的量为2mol。
综上所述,本题答案是:2。
(4) 从表中数据可知,TiCl4、TiBr4、TiI4三种卤代物的熔点沸点随着相对分质量的增大而增大,原因是TiCl4、TiBr4、TiI4都是分子晶体,而且组成和结构相似,其相对分子质量依次增大,分子间作用力逐渐增大,因而三者的熔点和沸点依次升高;
综上所述,本题答案是:TiCl4、TiBr4、TiI4都是分子晶体,而且组成和结构相似,其相对分子质量依次增大,分子间作用力逐渐增大,因而三者的熔点和沸点依次升高。
(5) Ti与O的个数比为1:1,化学式为(TiO)n2n+ (或TiO2+),SO42-中的S的σ电子对数为4,无孤对电子,故价层电子对数为4,属于sp3杂化;SO42-原子总数为5,价层电子总数为32,与其互为等电子体的分子为CCl4、SiCl4等。
综上所述,本题答案是:(TiO)n2n+ (或TiO2+) ,CCl4、SiCl4等。
(6)由钛的空间堆积方式可知其为六方最密堆积,钛原子的配位数为12;该结构中含有的钛原子个数为6个,质量为48×6/NAg;该结构的体积为:[![]() ×(2.95×10-8)2×4.69×10-8]cm3;则该晶体的密度为:48×6/[
×(2.95×10-8)2×4.69×10-8]cm3;则该晶体的密度为:48×6/[![]() ×(2.95×10-8)2×4.69×10-8NA] g·cm-3;
×(2.95×10-8)2×4.69×10-8NA] g·cm-3;
综上所述,本题答案是:六方最密堆积,12,48×6/[![]() ×(2.95×10-8)2×4.69×10-8NA]。
×(2.95×10-8)2×4.69×10-8NA]。

【题目】下列根据实验操作和现象所得出的结论不正确的是
选项 | 实验操作 | 实验现象 | 结论 |
A | 在A1C13溶液中逐滴滴入NaOH溶 液至过量,然后通入CO2气体 | 先出现白色沉淀,后沉淀消失,最后又出现白色沉淀 | Al(OH)3是两性氢氧化物,但不能溶解在某些弱酸中 |
B | 向浓度均为0.1mol/L的MgCl2、 CuCl2混合溶液中逐滴加入氨水 | 先出现蓝色沉淀 | Ksp[Mg(OH)2]>Ksp[Cu(OH)2] |
C | 向Na2CO 3溶液中加入浓盐酸,将产生的气体通入硅酸钠溶液中 | 产生白色浑浊 | 酸性:盐酸>碳酸>硅酸 |
D | 向盛有KI3溶液的两试管中分别加入淀粉溶液和AgNO3溶液 | 前者溶液变蓝色,后者有黄色沉淀 | KI3溶液中存在I3- |
A. A B. B C. C D. D