题目内容
【题目】亚硝酸钠(NaNO2)是一种工业盐,在生产、生活中应用广泛,外观酷似食盐且有咸味,是一种常用的发色剂和防腐剂,但使用过量会使人中毒。某学习小组通过如下装置(夹持及加热装置略去)制取NaNO2样品并对样品含量进行测定
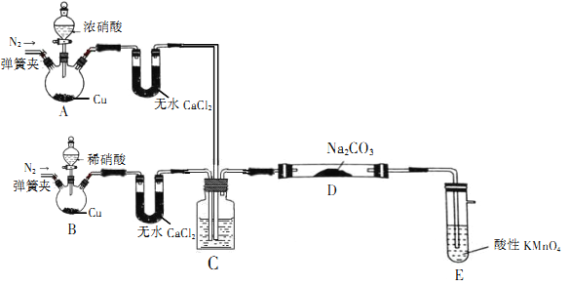
该小组先查阅资料知:NO、NO2能被酸性高锰酸钾氧化为NO3-。
(1)装置A中用于盛放浓硝酸的仪器名称为__________,装置D中发生的化学反应方程式为___________。
(2)①装置C中所装的液体需满足的条件是____________________。
②其作用为____________________。
(3)装置E的作用是____________________。
(4)为测定制得样品中NaNO2的含量,该实验中需配制KMnO4标准溶液并酸化,应选择__________(填化学式)来酸化KMnO4溶液。
(5)已知:在酸性溶液中,NO2-可将MnO4-还原为Mn2+。为测定样品中亚硝酸钠的含量,该小组称取4.0g样品溶于水配制成250mL溶液,取25.00mL溶液于锥形瓶中,用0.100mol·L-1的酸性KMnO4溶液进行滴定,消耗20.00mL酸性KMnO4溶液(杂质不反应)。滴定过程中酸性KMnO4溶液的作用是____________________,所得样品中NaNO2的质量分数为__________。
【答案】)分液漏斗 Na2CO3+NO2+NO=2NaNO2+CO2 既不能溶解NO2、NO,也不能与NO2、NO发生化学反应 通过观察广口瓶液体中产生气泡的速率来控制NO2、NO的混合比例 吸收过量的NO2、NO,避免尾气造成环境污染 H2SO4 做氧化剂和指示剂 86.25%
【解析】
(1) 装置A内铜和浓硝酸反应生成二氧化氮气体,装置B内铜和稀硝酸反应生成一氧化氮气体,两种气体与碳酸钠反应生成亚硝酸钠据此写出反应的方程式;
(2) 装置C的作用既可以使干燥一氧化氮、二氧化氮气体混合均匀,控制气体的流速,据此分析装置C中所装的液体需满足的条件及作用;
(3) 酸性高锰酸钾溶液能够把剩余的氮的氧化物吸收处理,以防止污染空气,据此分析装置E的作用;
(4) KMnO4溶液具有强氧化性,一般都用硫酸来酸化;
(5) NO2-可将MnO4-还原为Mn2+,体现了酸性KMnO4溶液的强氧化性,滴定终点的现象为滴入最后一滴酸性高锰酸钾溶液,溶液变成紫红色,且30s内颜色保持不变;所以高锰酸钾溶液除了起到氧化性的作用外,还能起到指示剂的作用;根据氧化还原反应中电子得失守恒关系:2MnO4-~5NO2-,计算出样品中含有亚硝酸钠的量及质量,最后计算出样品中NaNO2的质量分数。
(1) 控制液体的滴加速度,装置A中用于盛放浓硝酸的仪器为分液漏斗;装置A内铜和浓硝酸反应生成二氧化氮气体,装置B内铜和稀硝酸反应生成一氧化氮气体,两种气体与碳酸钠反应生成亚硝酸钠,反应的化学反应方程式为:Na2CO3+NO2+NO=2NaNO2+CO2 ;
综上所述,本题答案是:分液漏斗;Na2CO3+NO2+NO=2NaNO2+CO2 。
(2)①因为两个反应产生的NO2和NO最终要和碳酸钠反应,因此装置C中所装的液体需满足的条件是:既不能溶解NO2、NO,也不能与NO2、NO发生化学反应;
综上所述,本题答案是:既不能溶解NO2、NO,也不能与NO2、NO发生化学反应。
②该装置内所盛装的溶液除了使气体混合均匀,还可以通过观察C装置内液体中产生气泡的速率来控制NO2、NO的混合比例,以便NO2、NO混合气体尽可能与碳酸钠完全反应;
综上所述,本题答案是:通过观察广口瓶液体中产生气泡的速率来控制NO2、NO的混合比例 。
(3)根据信息可知,酸性高锰酸钾溶液能够把剩余的氮的氧化物吸收处理,以防止污染空气;因此装置E的作用是吸收过量的NO2、NO,避免尾气造成环境污染;
综上所述,本题答案是:吸收过量的NO2、NO,避免尾气造成环境污染。
(4) KMnO4溶液具有强氧化性,能够氧化盐酸,不能用盐酸酸化;而硝酸具有强氧化性,影响实验,稀硫酸性质稳定,不能被高锰酸钾溶液氧化;所以该实验中需配制KMnO4标准溶液并选择稀H2SO4来酸化。
综上所述,本题答案是:H2SO4。
(5) NO2-可将MnO4-还原为Mn2+,体现了酸性KMnO4溶液的强氧化性,滴定终点的现象为滴入最后一滴高锰酸钾溶液,溶液变成紫红色,且30s内颜色保持不变;以上利用了高锰酸钾的氧化性和做指示剂性质;消耗标准液的体积为20.00mL,25.00mL样品消耗高锰酸钾的物质的量为0.100mol·L-1×0.02 L=0.002mol;则250mL样品溶液会消耗高锰酸钾的物质的量为0.02 mol;根据化合价变化可得反应的关系式:2MnO4-~5NO2-,则4.0g样品中含有亚硝酸钠的物质的量为0.02mol×5/2=0.05 mol,质量为0.05×69=3.45g,所以所得样品中NaNO2的质量分数为3.45g/4.0g×100%=86.25%;
综上所述,本题答案是:做氧化剂和指示剂 ,86.25%。













