题目内容
【题目】将过量的0.2g铜粉与5mL1 molL1FeCl3溶液混合,充分振荡,溶液棕黄色变浅,溶液变绿,有灰白色固体出现。通过查阅资料,初步认为灰白色固体可能含CuCl(CuCl白色晶体,不溶于水、硫酸、稀硝酸,溶于氨水、浓盐酸溶液中,生成络合物)。为进一步探究灰白色固体是否含CuCl,进行一系列实验。已知:① CuCl+2NH3H2O![]() [Cu(NH3)2]++Cl+2H2O(无色溶液)② 提供的试剂:稀HNO3、AgNO3溶液、氨水、KSCN溶液
[Cu(NH3)2]++Cl+2H2O(无色溶液)② 提供的试剂:稀HNO3、AgNO3溶液、氨水、KSCN溶液
请回答下列问题:
(1)生成CuCl的化学方程式____________________________________。
(2)下列为常见的分离装置(装置中的其他仪器忽略),从上述溶液中分离出固体混合物,应选用的相应装置中的仪器名称是_______________。
A. B.
B. 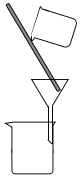 C.
C.![]() D.
D. E.
E. F.
F.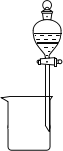
(3)提纯灰白色固体:将固体混合物用蒸馏水洗涤以除去固体表面的Fe3+、Cl。为检验固体混合物是否洗涤干净,最佳方案是检验洗涤液中是否含有_______(填离子符号),理由是_____________________________________________。
(4)设计实验检验得到的灰白色固体中含有CuCl,该实验过程中用到的试剂为____________________。
(5)实验测得灰白色固体混合物质量为a g,其中CuCl b g。上述实验过程中还有CuCl2生成,则生成CuCl2的物质的量是____________(列出计算式即可)。
【答案】FeCl3+Cu = FeCl2+CuCl 漏斗、玻璃棒、烧杯 Fe3+ CuCl有一定的溶解度,洗涤液中肯定会有Cl,无法判断固体表面的Cl是否洗涤干净 氨水、稀HNO3、AgNO3溶液 (![]() )mol
)mol
【解析】
根据过量的铜粉与FeCl3溶液混合时的现象,分析其中可能发生的反应。进而设计实验分离提纯混合物、探究反应产物,并进行有关计算。
(1)据题意,过量的铜粉与FeCl3溶液混合时,除主要反应2FeCl3+Cu =2FeCl2+CuCl2外,还生成CuCl。由Cu生成CuCl时铜元素化合价升高,则FeCl3变为FeCl2时铁元素化合价降低,化学方程式为FeCl3+Cu = FeCl2+CuCl。
(2)反应后溶液中有FeCl2、CuCl2和可能未反应的FeCl3,固体中有生成的CuCl和多余的Cu,使用过滤装置(B)进行分离,其中的仪器有漏斗、玻璃棒、烧杯。
(3)溶液中生成的沉淀表面吸附在可溶性杂质,故过滤后需洗涤沉淀;CuCl不溶于水,但溶解度不为零,洗涤液中肯定会有Cl,无法判断固体表面的Cl是否洗涤干净,故检验洗涤液中是否含有Fe3+。
(4)取少量经过洗涤的固体,先加氨水振荡并过滤,向滤液中滴加硝酸银溶液和稀硝酸,有白色溶液生成,则灰白色固体中含有CuCl。实验过程中用到的试剂氨水、AgNO3、稀HNO3。
(5)a g灰白色固体中,有 b gCuCl,则有(a-b) gCu。据题意有![]() +(a-b) g+
+(a-b) g+![]() =0.2g,解得n(CuCl2)=(
=0.2g,解得n(CuCl2)=(![]() )mol。
)mol。

 海淀课时新作业金榜卷系列答案
海淀课时新作业金榜卷系列答案 期末金牌卷系列答案
期末金牌卷系列答案 轻松课堂标准练系列答案
轻松课堂标准练系列答案






