题目内容
【题目】氧化铝在工业生产中有多种用途。请根据信息回答:
(1)以氧化铝为原料,通过碳热还原法可合成氮化铝(AlN)
己知:2Al2O3(s)=4Al(g)+3O2(g) △H1=+3351 kJ·mol-1
2C(s)+O2 (g)=2CO(g); △H2=-221 kJ·mol-1
2Al(g)+N2(g)=2AlN(s) △H3=-318 kJ·mol-1
则碳热还原法合成AlN的热化学方程式为_____。
(2)电解氧化铝生产铝时,阳极产生的副产物CO2,可通过CO2甲烷化再利用,反应原理为:CO2(g)+4H2(g)![]() CH4(g)+2H2O(g) △H4。
CH4(g)+2H2O(g) △H4。
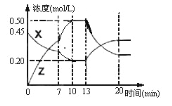
常压下以Ru/TiO2作催化剂,在恒容且容积相同的不同容器中,分别充入10mol CO2和H2的混合气体(体积比1:4)于不同温度下进行反应,第tmin时分别测定CH4的体积分数![]() ,并绘成如图甲所示曲线。
,并绘成如图甲所示曲线。
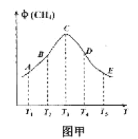
①A、B、C、D、E五点中,尚未达到平衡的点是___,该反应的△H4__0(填“>”或“<”)。
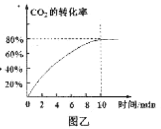
②350℃时,在2L恒容密闭容器中测得CO2的平衡转化率如图乙所示,则前10 min的平均反应速率v(CO2)=___;平衡常数为____
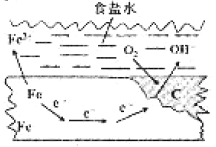
(3)据文献报道,科学家利用氮化镓材料与铜组成如图所示的人工光合系统装置,成功地以CO2和H2O为原料合成了CH4。
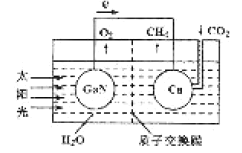
①写山铜电极表面的电极反应式____。
②为提高该人工光合系统的工作效率,可向装置中加入少量__(选填“盐酸”或“硫酸”)。
【答案】3C(s)+Al2O3(s)+N2(g)=2AlN(s)+3CO(g)△H=+1026kJ/mol; AB; <; 0.4mol/(L![]() min) 1 CO2+8e-+8H+=CH4+2H2O 硫酸
min) 1 CO2+8e-+8H+=CH4+2H2O 硫酸
【解析】
(1)利用盖斯定律进行计算;
(2)反应刚开始时,反应向正向进行,同时对应温度所对应的化学反应速率较慢,相同时间没有达到平衡,所以甲烷的体积分数增多,C点时恰好达到平衡,因为C点的时候,C点得温度高,对应的化学反应速率快,所以相同时间内恰好达到平衡,C点之后,温度升高速率更快,相同时间内提前达到平衡,接下来得时间温度影响平衡,使平衡发生移动,甲烷的体积分数减小;
(3)①根据电子移动方向判断出铜为正极;
②盐酸易挥发,所以不行;
(1)已知:①2Al2O3(s)=4Al(g)+3O2(g)△H1=+3351kJmol-1
②2C(s)+O2(g)=2CO(g)△H2=-221kJmol-1
③2Al(g)+N2(g)=2AlN(s)△H3=-318kJmol-1
盖斯定律计算(①+②×3+③×2)![]()
![]() 得到3C(s)+Al2O3(s)+N2(g)=2AlN(s)+3CO(g)△H=+1026kJ/mol;
得到3C(s)+Al2O3(s)+N2(g)=2AlN(s)+3CO(g)△H=+1026kJ/mol;
(2)①A、B、C、D、E五点中,尚未达到平衡的点是A和B,因为反应刚开始时,反应向正向进行,同时对应温度所对应的化学反应速率较慢,相同时间没有达到平衡,所以甲烷的体积分数增多,C点时恰好达到平衡,因为C点的时候,C点得温度高,对应的化学反应速率快,所以相同时间内恰好达到平衡,C点之后,温度升高速率更快,相同时间内提前达到平衡,接下来得时间温度影响平衡,使平衡发生移动,甲烷的体积分数减小;根据C点之后温度升高平衡向甲烷减少的方向移动,推测出温度升高平衡向逆向移动,所以该反应的△H4<0;
②在常压、Ru/TiO2催化下,CO2和H2混和气体(体积比1:4,总物质的量50mol)进行反应,平衡时容器体积为2L,二氧化碳的转化率为80%, CO2(g)+4H2(g)![]() CH4(g)+2H2O(g)
CH4(g)+2H2O(g)
起始(mol/L)52000
变化(mol/L)4 16 4 8
平衡(mol/L)1 4 4 8
所以v(CO2)=![]() =0.4mol/(L
=0.4mol/(L![]() min),反应的平衡常数K=
min),反应的平衡常数K=![]() =1;
=1;
(3)①根据电子移动方向判断出铜为正极,所以电极反应方程式为CO2+8e-+8H+=CH4+2H2O;
②为提高该人工光合系统的工作效率,可向装置中加入硫酸,来提高氢离子浓度,因为盐酸易挥发,所以不行;

 阅读快车系列答案
阅读快车系列答案