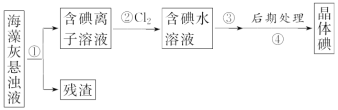
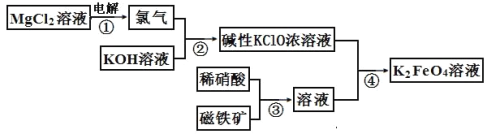
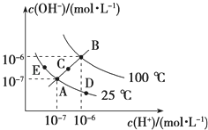
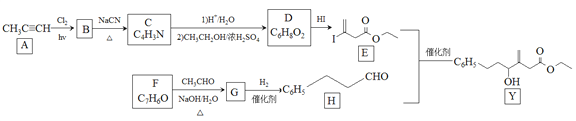
题目内容
【题目】(1)对于反应:2NO(g)+O2(g)![]() 2NO2(g),在其他条件相同时,分别测得NO的平衡转化率在不同压强(p1、p2)下温度变化的曲线如图:
2NO2(g),在其他条件相同时,分别测得NO的平衡转化率在不同压强(p1、p2)下温度变化的曲线如图:


①比较p1、p2的大小关系:________。
②随温度升高,该反应平衡常数变化的趋势是________(“增大”或“减小”)。
(2)在容积为1.00L的容器中,通入一定量的N2O4,发生反应N2O4(g)![]() 2NO2(g),随温度升高,混合气体的颜色变深。回答下列问题:
2NO2(g),随温度升高,混合气体的颜色变深。回答下列问题:
①反应的ΔH______0(填“大于”或“小于”);100℃时,体系中各物质浓度随时间变化如上图所示。在0~60s时段,反应速率v(N2O4)为__________________;平衡时混合气体中NO2的体积分数为_______。
②100℃时达平衡后,向容器中迅速充入含0.08mol的NO2和0.08mol N2O4 的混合气体,此时速率关系v(正)____v(逆)。(填“大于”,“等于”,或“小于”)
③100℃时达平衡后,改变反应温度为T,c(N2O4)以0.0020mol·L-1·s-1的平均速率降低,经10s又达到平衡。
a.T________100℃(填“大于”或“小于”),判断理由是____________________
b.列式计算温度T时反应的平衡常数K2(写计算过程):______
【答案】p2>p1 减小 大于 0.0010 mol·L-1·s-1 75% 大于 大于 反应正方向吸热,反应向吸热方向进行,故温度升高 1.28
【解析】
(1)①已知2NO(g)+O2(g)2NO2(g)是正方向体积减小的反应,根据压强对平衡的影响分析;
②根据图象判断该反应正方向是放热还是吸热,再判断K随温度的变化;
(2)①随温度的升高,混合气体的颜色变深,化学平衡向正反应方向移动,据此判断;根据v=![]() 计算速率;求平衡时混合气体中NO2的体积分数可利用三段式;
计算速率;求平衡时混合气体中NO2的体积分数可利用三段式;
②计算浓度商Qc,再和平衡常数K比较,根据大小关系判断平衡移动方向,从而比较正逆反应速率的相对大小;
③N2O4的浓度降低,平衡向正反应方向移动,由于正反应方向吸热,T>100℃;计算平衡常数可利用三段式。
(1)①已知2NO(g)+O2(g)2NO2(g)是正方向体积减小的反应,增大压强平衡正移,则NO的转化率会增大,由图可知p2时NO的转化率大,则p2时压强大,即p2>p1,
故答案为:p2>p1;
②由图象可知,随着温度的升高,NO的转化率减小,说明升高温度平衡逆移,则该反应正方向是放热反应,所以升高温度平衡常数K减小,
故答案为:减小;
(2)①由题意及图示知,在1.00 L的容器中,通入0.100 mol的N2O4,发生反应:N2O4(g)![]() 2NO2(g),随温度升高混合气体的颜色变深,说明反应向生成NO2的方向移动,即向正反应方向移动,所以正反应为吸热反应,即ΔH>0;
2NO2(g),随温度升高混合气体的颜色变深,说明反应向生成NO2的方向移动,即向正反应方向移动,所以正反应为吸热反应,即ΔH>0;
由图示知60s时该反应达到平衡,消耗N2O4为0.100 mol·L-1-0.040 mol·L-1=0.060 mol·L-1,根据v=![]() 可知:v(N2O4)=
可知:v(N2O4)=![]() =0.0010 mol·L-1·s-1;
=0.0010 mol·L-1·s-1;
求平衡时混合气体中NO2的体积分数可利用三段式:
N2O4(g)![]() 2NO2(g)
2NO2(g)
起始量/(mol·L-1) 0.100 0
转化量/(mol·L-1) 0.060 0.120
平衡量/(mol·L-1) 0.040 0.120
平衡时NO2的体积分数=![]() 100%=75%,
100%=75%,
故答案为:大于;0.0010 mol·L-1·s-1 ;75%;
②温度T时反应达平衡后,向容器中,迅速充入含0.08mol的NO2和0.08mol N2O4的混合气体,容器体积为1L,则此时浓度商Qc=![]() =0.33<K=
=0.33<K=![]() =0.36,反应向正反应进行,则断v(正)>v(逆),
=0.36,反应向正反应进行,则断v(正)>v(逆),
故答案为:大于;
③100 ℃时达平衡后,改变反应温度为T,c(N2O4)降低,说明平衡N2O4(g)![]() 2NO2(g)
2NO2(g)
向正反应方向移动,根据勒夏特列原理,温度升高,向吸热反应方向移动,即向正反应方向移动,故T>100 ℃;由c(N2O4)以0.0020 mol·L-1·s-1的平均速率降低,经10 s又达到平衡,可知此时消耗N2O4为:0.0020 mol·L-1·s-1×10 s=0.020 mol·L-1,
由三段式:
N2O4(g)![]() 2NO2(g)
2NO2(g)
起始量/(mol·L-1) 0.040 0.120
转化量/(mol·L-1) 0.020 0.040
平衡量/(mol·L-1) 0.020 0.160
K2=![]() =
=![]() =1.28。
=1.28。
故答案为:大于;反应正方向吸热,反应向吸热方向进行,故温度升高;1.28。

 名师金手指领衔课时系列答案
名师金手指领衔课时系列答案【题目】含锌废渣及粉尘是危险废物,碱浸电解法处理可得锌粉。但若其中存在氯,则锌质量就严重下降,对电极板也有严重腐蚀作用。工业上模拟碱浸电解法处理含锌质量分数为16%的废料(主要成分为ZnO、Zn(OH)2、ZnSO4及PbCO3、Fe2O3、Cu杂质)工艺如图:
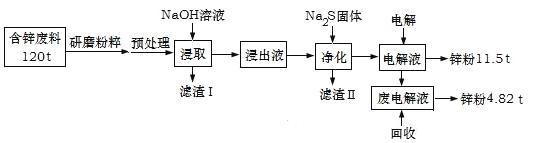
ⅰ.浸出液中含有[Zn(OH)4]2-和[Pb(OH)4]2-等离子
ⅱ.滤渣Ⅱ的主要成分为:Na2Pb(OH)xS![]()
(1)从物质分类的角度看,ZnO属于__,其与NaOH溶液发生反应的离子方程式为__。
(2)“滤渣Ⅰ”的主要成分为___。
(3)下表是“预处理”的2种除氯方案中粉尘氯的去除率和锌损失率分析表格可知,首选的“除氯剂”为___,原因是____。
除氯剂 | 碱(NaOH) | 碳酸钠 |
氯去除率/% | 78.75 | 83.69 |
锌损失率/% | 0.26 | 0.28 |
价格/t | 7200元 | 3600元 |
(4)“电解”过程中阴极的电极反应式为____。
(5)锌的总回收率为____。