题目内容
9. 如图是元素周期表的一部分,关于元素X、Y、Z的叙述正确的是( )
如图是元素周期表的一部分,关于元素X、Y、Z的叙述正确的是( )①X的气态氢化物与Y的最高价氧化物对应的水化物能发生反应生成盐
②Y、Z的气态氢化物水溶液的均显酸性
③Z的单质在常温下是液体
④Z的原子序数比Y大19
⑤Z所在的周期中含有32种元素.
| A. | ①②③④ | B. | ①②③④⑤ | C. | 只有③ | D. | 只有①④ |
分析 如图是元素周期表的一部分,则R为He、X为氮元素、Y为硫元素、Z为Br元素,
①氨气与硫酸反应可以生成硫酸铵;
②硫化氢和溴化氢为酸;
③溴常温下为液体;
④Br的原子序数比S大19;
⑤Br所在的周期中含有18种元素.
解答 解:如图是元素周期表的一部分,则R为He、X为氮元素、Y为硫元素、Z为Br元素,
①氨气与硫酸反应可以生成硫酸铵,属于盐,故正确;
②Y、Z的气态氢化物分别为硫化氢、溴化氢,硫化氢和溴化氢为酸,二者水溶液均显酸性,故正确;
③Z为溴元素,其单质常温下为液体,故正确;
④S的原子序数为16,Br的原子序数为35,则Br的原子序数比S大19,故正确;
⑤Br处于第四周期,所在的周期中含有18种元素,故错误.
故选A.
点评 本题考查元素周期表的结构、元素化合物的性质等,比较基础,注意整体把握元素周期表的结构.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
18.下列一组粒子的中心原子杂化类型相同,分子或离子的键角不相等的是( )
| A. | CCl4、SiCl4、SiH4 | B. | H2S、NF3、CH4 | ||
| C. | BCl3、CH2═CHCl、环己烷 | D. | SO3、C6H6(苯)、CH3C≡CH |
17.下列离子方程式书写正确的是( )
| A. | 碳酸银溶于稀硝酸:Ag2CO3+2H+═2Ag++CO2↑+H2O | |
| B. | AlCl3溶液中加入过量的氢氧化钠溶液:Al3++3OH-═Al(OH)3↓ | |
| C. | 硅酸钠溶液与盐酸混合:Na2SiO3+2H+═H2SiO3(胶体)+2Na+ | |
| D. | 澄清石灰水中加入足量的碳酸氢钠溶液:Ca2++HCO3-+OH-═CaCO3↓+H2O |
4.下列与有机物的结构、性质有关的叙述正确的是( )
| A. | 苯不能使酸性高锰酸钾溶液褪色,所以苯不能发生氧化反应 | |
| B. | 石油裂解的目的是为了提高轻质液体燃料的产量和质量 | |
| C. | 丙烯分子中所有原子不可能在同一平面上 | |
| D. | 蛋白质、糖类、油脂均能发生水解反应 |
14.A、B、C、D为四种主族元素,A、B元素的阳离子和C、D元素的阴离子都具有相同的电子层结构,且A的阳离子的氧化性比B的阳离子的氧化性弱,C的阴离子所带的负电荷比D的阴离子所带的负电荷多,则它们的原子半径由大至小的顺序是( )
| A. | D>C>B>A | B. | A>B>C>D | C. | B>A>C>D | D. | A>B>D>C |
1.为探究同周期元素性质的递变规律,某课外小组同学进行了如下实验:
请在下表中填写与实验步骤对应的实验现象序号:
| 实验步骤 | 1.将一小块金属钠放入滴有酚酞溶液的冷水中; 2.将一小段用砂纸打磨后的镁带放入试管中,加入少量水,加热至水沸腾,冷却后,向试管中滴加酚酞溶液; 3.将一小段镁带投入稀盐酸中; 4.将一小片铝投入稀盐酸中. |
| 实验现象 | A.剧烈反应,迅速生成大量的气体 B.浮在水面上,熔成小球,不断游动,小球渐小最终消失,溶液变红 C.反应不剧烈,产生无色气体 D.有气体产生,溶液变成红色 |
| 实验步骤 | 1 | 2 | 3 | 4 |
| 实验现象 | B | D | A | C |
19.下列各组离子中,能大量共存的是( )
| A. | NH4+、Na+、Cl-、OH- | B. | Fe2+、H+、NO3-、SO42- | ||
| C. | NH4+、K+、HCO3-、OH- | D. | Fe3+、NH4+、NO3-、SO42- |
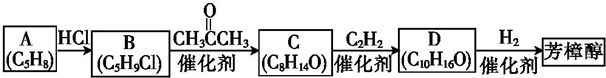
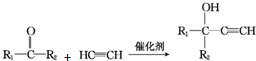 (R1、R2均为烃基)
(R1、R2均为烃基) ,该反应类型为加成反应.
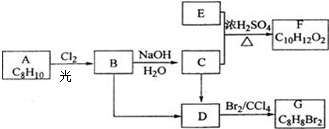
,该反应类型为加成反应. .
.

 +NaOH$→_{△}^{醇}$
+NaOH$→_{△}^{醇}$ +NaCl+H2O
+NaCl+H2O
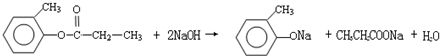 .
.