题目内容
19.下列各组离子中,能大量共存的是( )| A. | NH4+、Na+、Cl-、OH- | B. | Fe2+、H+、NO3-、SO42- | ||
| C. | NH4+、K+、HCO3-、OH- | D. | Fe3+、NH4+、NO3-、SO42- |
分析 A.铵根离子、氢氧根离子之间发生反应生成一水合氨;
B.硝酸根离子在酸性溶液中能够氧化亚铁离子;
C.铵根离子、碳酸氢根离子都能够与氢氧根离子反应;
D.四种离子之间不反应,在溶液中能够共存.
解答 解:A.NH4+、OH-之间发生反应生成一水合氨,在溶液中不能大量共存,故A错误;
B.Fe2+、H+、NO3-发生氧化还原反应,在溶液中不能大量共存,故B错误;
C.NH4+、HCO3-都与OH-反应,在溶液中不能大量共存,故C错误;
D.Fe3+、NH4+、NO3-、SO42-离子之间不发生反应,在溶液中能够大量共存,故D正确;
故选D.
点评 本题考查离子共存的判断,为高考的高频题,属于中等难度的试题,注意明确离子不能大量共存的一般情况,如:能发生复分解反应的离子之间,能发生氧化还原反应的离子之间,能发生络合反应的离子之间(如 Fe3+和 SCN-)等;还应该注意题目所隐含的条件,如:溶液的酸碱性,据此来判断溶液中是否有大量的 H+或OH-;溶液的颜色,如无色时可排除 Cu2+、Fe2+、Fe3+、MnO4-等有色离子的存在;试题侧重对学生基础知识的训练和检验,有利于培养学生的逻辑推理能力,提高学生灵活运用基础知识的能力.

练习册系列答案
 永乾教育寒假作业快乐假期延边人民出版社系列答案
永乾教育寒假作业快乐假期延边人民出版社系列答案
相关题目
9. 如图是元素周期表的一部分,关于元素X、Y、Z的叙述正确的是( )
如图是元素周期表的一部分,关于元素X、Y、Z的叙述正确的是( )
①X的气态氢化物与Y的最高价氧化物对应的水化物能发生反应生成盐
②Y、Z的气态氢化物水溶液的均显酸性
③Z的单质在常温下是液体
④Z的原子序数比Y大19
⑤Z所在的周期中含有32种元素.
 如图是元素周期表的一部分,关于元素X、Y、Z的叙述正确的是( )
如图是元素周期表的一部分,关于元素X、Y、Z的叙述正确的是( )①X的气态氢化物与Y的最高价氧化物对应的水化物能发生反应生成盐
②Y、Z的气态氢化物水溶液的均显酸性
③Z的单质在常温下是液体
④Z的原子序数比Y大19
⑤Z所在的周期中含有32种元素.
| A. | ①②③④ | B. | ①②③④⑤ | C. | 只有③ | D. | 只有①④ |
10.现有部分元素的性质与原子(或分子)结构如表:
(1)写出元素T的原子结构示意图 .
.
(2)元素Y与元素Z相比,金属性较强的是Na(用元素符号表示),下列表述中能证明这一事实的是cd(填序号).
a.Y单质的熔点比Z单质低
b.Y的化合价比Z低
c.Y单质与水反应比Z单质剧烈
d.Y最高价氧化物的水化物的碱性比Z强
(3)T、X、Y、Z中有两种元素能形成既有离子键又有非极性共价键的化合物,写出该化合物的电子式: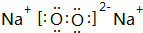 .
.
(4)元素T和氢元素以原子个数比1:1化合形成化合物Q,元素X与氢元素以原子个数比1:2化合形成常用作火箭燃料的化合物W,Q与W发生氧化还原反应,生成X单质和T的另一种氢化物,写出该反应的化学方程式:N2H4+2H2O2═N2↑+4H2O.
(5)T、W(+4价)、Y形成的正盐溶液中含有溶质0.20mol,另一溶液是200mL盐酸,不管将前者滴加入后者,还是将后者滴加入前者,都有气体产生,但最终生成的气体体积不同,则盐酸的浓度合理的是B
A.2.0mol/L B.1.5mol/L C.0.18mol/L D.0.24mol/L.
| 元素编号 | 元素性质与原子(或分子)结构 | |
| T | 最外层电子数是次外层电子数的3倍 | |
| X | 常温下单质为双原子分子,分子中含有3对共用电子对 | |
| Y | M层比K层少1个电子 | |
| Z | 第三周期元素的简单离子中半径最小 | |
| W | W带两个负电荷的阴离子与Ar具有相同电子层结构 | |
 .
.(2)元素Y与元素Z相比,金属性较强的是Na(用元素符号表示),下列表述中能证明这一事实的是cd(填序号).
a.Y单质的熔点比Z单质低
b.Y的化合价比Z低
c.Y单质与水反应比Z单质剧烈
d.Y最高价氧化物的水化物的碱性比Z强
(3)T、X、Y、Z中有两种元素能形成既有离子键又有非极性共价键的化合物,写出该化合物的电子式:
 .
.(4)元素T和氢元素以原子个数比1:1化合形成化合物Q,元素X与氢元素以原子个数比1:2化合形成常用作火箭燃料的化合物W,Q与W发生氧化还原反应,生成X单质和T的另一种氢化物,写出该反应的化学方程式:N2H4+2H2O2═N2↑+4H2O.
(5)T、W(+4价)、Y形成的正盐溶液中含有溶质0.20mol,另一溶液是200mL盐酸,不管将前者滴加入后者,还是将后者滴加入前者,都有气体产生,但最终生成的气体体积不同,则盐酸的浓度合理的是B
A.2.0mol/L B.1.5mol/L C.0.18mol/L D.0.24mol/L.
14.下列说法正确的是( )
| A. | 1 mol阿司匹林(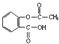 )与足量的NaOH溶液反应,消耗NaOH最大的物质的量为2mol )与足量的NaOH溶液反应,消耗NaOH最大的物质的量为2mol | |
| B. | 汽油、柴油等矿物油与植物油主要成分都是烃,均可以萃取溴水中的溴 | |
| C. | 丙氨酸和苯丙氨酸脱水,最多可生成4种二肽 | |
| D. | 苯酚能与溴水反应,苯不能与溴水反应,说明苯环对羟基有影响 |
8.有Wn+、Xm+、Ym-、Zn-(m>n)四种主族元素离子,且W、X、Y、Z四种原子的M电子层中的电子数均为奇数.下列说法中正确的是( )
| A. | Wn+、Xm+、Ym-、Zn-的离子半径依次增大 | |
| B. | Y、Z的气态氢化物的热稳定性:HmY>HnZ | |
| C. | W、X、Y、Z的最高价氧化物对应的水化物都是强电解质 | |
| D. | W、X、Y、Z的最高价氧化物对应的水化物的碱性依次减弱,酸性依次增强 |
9.第三周期元素中非金属性最强的是( )
| A. | Al | B. | Cl | C. | Mg | D. | Si |
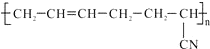 ,其具有优良的耐油、耐高温性能,合成丁腈橡胶的原料是( )
,其具有优良的耐油、耐高温性能,合成丁腈橡胶的原料是( )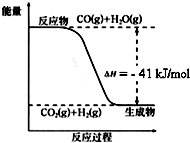 已知工业制氢气的反应为CO(g)+H2O(g)?CO2(g)+H2(g),反应过程中能量变化如图所示.在500℃时的平衡常数 K=9.若在2L的密闭容器中CO和水蒸气的起始浓度都是0.1mol/L,10min时达到平衡状态.
已知工业制氢气的反应为CO(g)+H2O(g)?CO2(g)+H2(g),反应过程中能量变化如图所示.在500℃时的平衡常数 K=9.若在2L的密闭容器中CO和水蒸气的起始浓度都是0.1mol/L,10min时达到平衡状态.