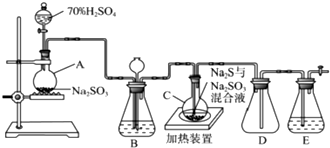
题目内容
4.FeCl3的水溶液常温时的pH<7(填“>”、“=”、“<”),原因是:Fe3++3H2O$\stackrel{高温}{?}$Fe(OH)3+3H+用离子方程式表示);实验室如何配制FeCl3溶液将FeCl3晶体溶于少量浓盐酸中,再加入水稀释到所需要的浓度.
分析 FeCl3是强酸弱碱盐,铁离子水解而导致其溶液呈酸性;为防止氯化铁水解,在配制氯化铁溶液时,常将FeCl3固体先溶于较浓的盐酸中.
解答 解:FeCl3是强酸弱碱盐,铁离子水解而导致其溶液呈酸性,水解离子方程式为Fe3++3H2O?Fe(OH)3+2H+,所以其溶液pH<7;在配制氯化铁溶液时,常将FeCl3固体先溶于较浓的盐酸中,从而抑制氯化铁水解,
故答案为:<;Fe3++3H2O$\stackrel{高温}{?}$ Fe (OH)3+3H+;将FeCl3晶体溶于少量浓盐酸中,再加入水稀释到所需要的浓度.
点评 本题考查了盐类水解,根据“谁强谁显性、谁弱谁水解”来确定溶液酸碱性,根据溶液酸碱性加入相应的酸或碱防止其水解,题目难度不大.

练习册系列答案
相关题目
14.下列有关化工生产的叙述中,正确的是( )
| A. | 工业上可用氯化钠制备化肥NH4Cl | |
| B. | 氯碱工业中,电解槽的阳极区产生NaOH | |
| C. | 在接触室被氧化成SO3,SO3在吸收塔内被水吸收制成浓硫酸 | |
| D. | 工业上用石英制太阳能电池,在高温下用铝热法炼铁制备钢材 |
12.下列过程一定放出热量的是( )
| A. | 化合反应 | B. | 分解反应 | C. | 由原子形成分子 | D. | 由分子变成原子 |
19.A的分子式为C8H16O2,可发生如下转化: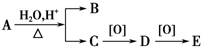 其中B与E互为同分异构体,则A可能的结构有( )
其中B与E互为同分异构体,则A可能的结构有( )
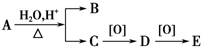 其中B与E互为同分异构体,则A可能的结构有( )
其中B与E互为同分异构体,则A可能的结构有( )| A. | 8种 | B. | 4种 | C. | 2种 | D. | 1种 |
9.常温下,下列各组离子在指定溶液中一定能大量共存的是( )
| A. | 中性溶液Cu2+、Al3+、NO3-、SO42- | |
| B. | 加入苯酚显紫色的溶液:K+、NH4+、Cl-、I- | |
| C. | $\frac{{K}_{W}}{c{(H}^{+})}$=10-13mol•L-1的溶液:Na+、[Ag(NH3)2]+、OH-、NO3- | |
| D. | c(I-)=0.1 mol•L-1的溶液中:Na+、H+、ClO-、SO42- |
16. 某实验小组用0.50mol/L NaOH溶液和0.50mol/L硫酸溶液进行中和热的测定.
某实验小组用0.50mol/L NaOH溶液和0.50mol/L硫酸溶液进行中和热的测定.
Ⅰ.配制0.50mol/L NaOH溶液
(1)若实验中大约要使用245mL NaOH溶液,至少需要称量NaOH固体5.0g.
(2)从表中选择称量NaOH固体所需要的仪器是(填字母):a b e.
Ⅱ.测定稀硫酸和稀氢氧化钠中和热的实验装置如图所示.
(1)写出该反应的热化学方程式(中和热为57.3kJ/mol):$\frac{1}{2}$H2SO4(aq)+NaOH(aq)=$\frac{1}{2}$Na2SO4(aq)+H2O(l)△H=-57.3kJ/mol.
(2)取50mL NaOH溶液和30mL硫酸溶液进行实验,实验数据如表.
①请填写下表中的空白:
②近似认为0.50mol/L NaOH溶液和0.50mol/L硫酸溶液的密度都是1g/cm3,中和后生成溶液的比热容c=4.18J/(g•℃).则中和热△H=-53.5kJ/mol(取小数点后一位).
③上述实验数值结果与57.3kJ/mol有偏差,产生偏差的原因可能是(填字母)acd.
a.实验装置保温、隔热效果差
b.量取NaOH溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度.
 某实验小组用0.50mol/L NaOH溶液和0.50mol/L硫酸溶液进行中和热的测定.
某实验小组用0.50mol/L NaOH溶液和0.50mol/L硫酸溶液进行中和热的测定.Ⅰ.配制0.50mol/L NaOH溶液
(1)若实验中大约要使用245mL NaOH溶液,至少需要称量NaOH固体5.0g.
(2)从表中选择称量NaOH固体所需要的仪器是(填字母):a b e.
| 名称 | 托盘天平(带砝码) | 小烧杯 | 坩埚钳 | 玻璃棒 | 药匙 | 量筒 |
| 仪器 |  |  |  |  |  |  |
| 序号 | a | b | c | d | e | f |
(1)写出该反应的热化学方程式(中和热为57.3kJ/mol):$\frac{1}{2}$H2SO4(aq)+NaOH(aq)=$\frac{1}{2}$Na2SO4(aq)+H2O(l)△H=-57.3kJ/mol.
(2)取50mL NaOH溶液和30mL硫酸溶液进行实验,实验数据如表.
①请填写下表中的空白:
| 温度 实验 次数 | 起始温度t1/℃ | 终止温度 t2/℃ | 温度差平均值 (t2-t1)/℃ | ||
| H2SO4 | NaOH | 平均值 | |||
| 1 | 26.2 | 26.0 | 26.1 | 30.1 | |
| 2 | 27.0 | 27.4 | 27.2 | 31.3 | |
| 3 | 25.9 | 25.9 | 25.9 | 29.8 | |
| 4 | 26.4 | 26.2 | 26.3 | 30.4 | |
③上述实验数值结果与57.3kJ/mol有偏差,产生偏差的原因可能是(填字母)acd.
a.实验装置保温、隔热效果差
b.量取NaOH溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度.
13.氧化还原反应中,水的作用可以是氧化剂、还原剂、既是氧化剂又是还原剂、既不是氧化剂也不是还原剂.下列反应与Cl2+SO2+2H2O=H2SO4+2HCl相比较,水的作用完全相同的是( )
| A. | 2H2O $\frac{\underline{\;电解\;}}{\;}$ 2H2↑+O2↑ | B. | 4Fe(OH)2+O2+2H2O=4Fe(OH)3 | ||
| C. | 2Na+2H2O=2NaOH+H2↑ | D. | Cl2+H2O=HCl+HClO |