题目内容
14.在反应2KMnO4+16HCl(浓)=2KC1+2MnC2+5Cl2↑+8H2O中:(1)Mn元素被还原,Cl元素失电子.
(2)氧化剂与还原剂的物质的量比是1:5.
(3)若有7.3gHCl被氧化,产生的Cl2在标准状下的体积为1.12L.
(4)反应的离子方程式为2MnO4-+10Cl-+16H+=2Mn2++5Cl2↑+8H2O.
分析 由方程式可知,反应中Mn元素化合价由+7价降低到+2价,被还原,KMnO4为氧化剂,Cl元素化合价由-1价升高到0价,被氧化,HCl为还原剂,结合化合价的变化以及反应的方程式计算.
解答 解:(1)反应中KMnO4为氧化剂,Mn元素的化合价由+7价降低到+2价,被还原,Cl元素化合价由-1价升高到0价,被氧化,故答案为:Mn;Cl;
(2)由方程式可知当有2molKMnO4参加反应时,生成5molCl2,则有10molHCl被氧化,则氧化剂与还原剂的物质的量比是1:5,故答案为:1:5;
(3)n(HCl)=$\frac{7.3g}{73g/mol}$=0.1mol,可生成n(Cl2)=0.05mol,V(Cl2)=0.05mol×22.4L/mol=1.12L,故答案为:1.12L;
(4)反应的离子方程式为2MnO4-+10Cl-+16H+=2Mn2++5Cl2↑+8H2O,故答案为:2MnO4-+10Cl-+16H+=2Mn2++5Cl2↑+8H2O.
点评 本题考查氧化还原反应,侧重于学生的分析能力和计算能力的考查,为高频考点,注意从元素化合价的角度认识氧化还原反应的相关概念和物质的性质,难度不大.

练习册系列答案
 阳光课堂课时优化作业系列答案
阳光课堂课时优化作业系列答案
相关题目
5.下列物质属于天然高分子化合物的是( )
| A. | 淀粉 | B. | 蔗糖 | C. | 油脂 | D. | 葡萄糖 |
9.将少量锌与20mL0.2mol•L-1盐酸在烧杯中混合,下列操作能加快反应速率但不会影响生成氢气生成量的方法是( )
①向烧杯中加入2mL2mol•L-1的盐酸 ②向烧杯中加入少量炭粉 ③加入少量CuCl2晶体 ④加热.
①向烧杯中加入2mL2mol•L-1的盐酸 ②向烧杯中加入少量炭粉 ③加入少量CuCl2晶体 ④加热.
| A. | ①② | B. | ③④ | C. | ①②④ | D. | ②③④ |
9.实验室以含有Ca2+、Mg2+、Cl-、SO42-、Br-等离子的卤水为主要原料制备无水CaCl2和Br2,流程如下:
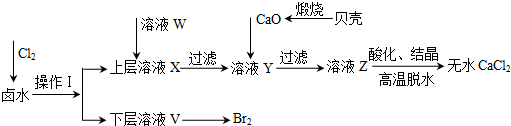
(1)操作Ⅰ使用的试剂是四氯化碳,所用的主要仪器名称是分液漏斗.
(2)加入溶液W的目的是除去溶液中的SO42-.用CaO调节溶液Y的pH,可以除去Mg2+.由表中数据可知,理论上可选择的pH最大范围是11.0≤pH<12.2.酸化溶液Z时,使用的试剂为盐酸.

(1)操作Ⅰ使用的试剂是四氯化碳,所用的主要仪器名称是分液漏斗.
(2)加入溶液W的目的是除去溶液中的SO42-.用CaO调节溶液Y的pH,可以除去Mg2+.由表中数据可知,理论上可选择的pH最大范围是11.0≤pH<12.2.酸化溶液Z时,使用的试剂为盐酸.
| 开始沉淀时的pH | 沉淀完全时的pH | |
| Mg2+ | 9.6 | 11.0 |
| Ca2+ | 12.2 | c(OH-)=1.8mol•L-1 |
10.已知氧化性Fe3+>I2.FeI2溶液中通入一定量的Cl2,发生反应的离子方程式为:a Fe2++bI-+c Cl2→d Fe3++e I2+f Cl-下列选项中的数字与离子方程式中的a、b、c、d、e、f一一对应,其中不符合反应实际的是( )
| A. | 2 0 1 2 0 2 | B. | 0 2 1 0 1 2 | ||
| C. | 2 4 3 2 2 6 | D. | 2 10 6 2 5 12 |
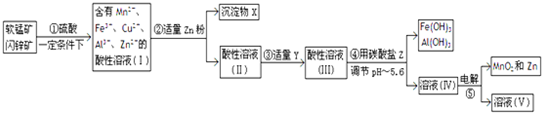
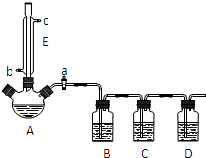 某兴趣小组同学设计了如下装置(其中夹持仪器、加热仪器及冷却水管没有画出),用加热苯甲酸、浓H2SO4和乙醇混合物的方法来制备苯甲酸乙酯,并检验反应的部分副产物.且苯甲酸乙酯的沸点为213℃,乙醚的沸点为34.6℃.
某兴趣小组同学设计了如下装置(其中夹持仪器、加热仪器及冷却水管没有画出),用加热苯甲酸、浓H2SO4和乙醇混合物的方法来制备苯甲酸乙酯,并检验反应的部分副产物.且苯甲酸乙酯的沸点为213℃,乙醚的沸点为34.6℃.