题目内容
【题目】Ni-MH电池在工农业生产和日常生活中具有广泛用途,废旧电池中含有大量金属元素,其回收利用具有非常重要的意义。一种利用废Ni-MH电池正极材料(主要含有Ni(OH)2,还含有少量Fe、Cu、Ca、Mg、Mn、Zn的氢氧化物)制备电子级硫酸镍晶体的工艺流程如下图所示:

回答下列问题:
(1)“浸出”时温度、硫酸浓度、浸出时间对镍浸出率的影响如下图:

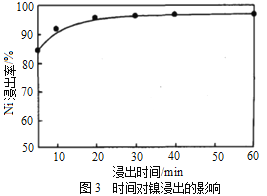
则“浸出”时最适宜的条件为_______________。
(2)在“滤液1”中加入双氧水可将Fe2+转化为难溶的针铁矿(FeOOH),写出反应的离子方程式:______________。
(3)“滤液2”中加入NaF可将滤液中Ca2+、Mg2+转化为难溶的CaF2和MgF2。当加入过量NaF后,所得“滤液3”中c(Mg2+)∶c(Ca2+)=0.67,则MgF2的溶度积为_____________[已知Ksp(CaF2)=1.10×10-10]。
(4)向“滤液3”中加入(NH4)2S2O8可以除锰,在此过程中(NH4)2S2O8与MnSO4反应生成含锰元素的一种黑色不溶物、硫酸铵及硫酸,写出该反应的化学方程式___________________。
(5)向“滤液4”加入有机萃取剂后,Zn2+与有机萃取剂(用HA表示)形成易溶于萃取剂的络合物ZnA2·2HA。该过程可以表示为:Zn2++4HA![]() ZnA2·2HA+2H+
ZnA2·2HA+2H+
①已知加入萃取剂后,锌的萃取率随料液pH变化如图所示。试分析pH增大时,锌的萃取率逐渐增大的原因是___________________。
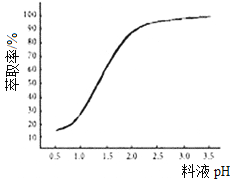
②“操作X”的名称是_____________。
(6)上述回收镍的过程中,使用了1kg含镍37.1%的正极材料,最终得到纯净的NiSO4·7H2O1.686kg,则镍的回收率为_______________。
【答案】 80℃ ,1.8mol/LH2SO4,30min 2Fe2++H2O2+2H2O=2FeOOH↓+4H+ 7.37×10-11 (NH4)2S2O8+MnSO4+2H2O=MnO2↓+(NH4)2SO4+2H2SO4 料液的pH增大,使料液中的c(H+)减小,促使Zn2++4HA![]() ZnA2·2HA+2H+向右进行,锌的萃取率增大 分液 95.4%
ZnA2·2HA+2H+向右进行,锌的萃取率增大 分液 95.4%
【解析】分析:本题以利用废Ni-MH电池正极材料制备电子级硫酸镍晶体的工艺流程为载体,考查流程的分析、图像分析、适宜条件的选择、外界条件对化学平衡的影响、指定情境下方程式的书写、溶度积的计算、化学实验的基本操作和化学计算。废Ni-MH电池正极材料加H2SO4浸出时,金属的氢氧化物转化成相应的硫酸盐;浸出液中加入Na2S将Cu2+转化为CuS沉淀除去;向“滤液1”中加入双氧水将Fe2+转化为FeOOH沉淀除去;向“滤液2”中加入NaF将Ca2+、Mg2+转化为CaF2、MgF2沉淀而除去;向“滤液3”中加入(NH4)2S2O8除去Mn2+;“滤液4”中用有机萃取剂除去Zn2+。
详解:(1)根据图1,“浸出”最佳温度约为80℃;根据图2,随着硫酸浓度的增大Ni浸出率增大,硫酸浓度为1.8mol/L时Ni浸出率已经很大,当硫酸浓度大于1.8mol/L,继续增大硫酸浓度Ni浸出率增大不明显,硫酸最适宜浓度为1.8mol/L;根据图3,“浸出”时间小于30min随着时间的延长Ni浸出率明显增大,大于30minNi浸出率趋于平缓,最佳时间为30min;“浸出”时最适宜的条件是:温度为80℃、硫酸浓度为1.8mol/L、时间为30min。
(2)双氧水将Fe2+转化为FeOOH沉淀,Fe2+被氧化,H2O2被还原,根据得失电子守恒、原子守恒和电荷守恒,反应的离子方程式为2Fe2++H2O2+2H2O=2FeOOH↓+4H+。
(3)当加入过量NaF后,Ksp(MgF2)=c(Mg2+)·c2(F-),Ksp(CaF2)= c(Ca2+)·c2(F-),将两式相比消去c2(F-),Ksp(MgF2)= Ksp(CaF2)![]() =1.10
=1.10![]() 10-10
10-10![]() 0.67=7.37
0.67=7.37![]() 10-11。
10-11。
(4)(NH4)2S2O8与MnSO4反应生成含锰元素的一种黑色不溶物、(NH4)2SO4和H2SO4,含锰元素的黑色不溶物为MnO2,反应可写成(NH4)2S2O8+MnSO4→MnO2↓+(NH4)2SO4+H2SO4,Mn元素的化合价由+2价升至+4价,S元素的化合价由+7价降至+6价,根据得失电子守恒和原子守恒配平,(NH4)2S2O8与MnSO4反应的化学方程式为:(NH4)2S2O8+MnSO4+2H2O=MnO2↓+(NH4)2SO4+2H2SO4。
(5)①pH增大时,锌的萃取率逐渐增大的原因是:料液pH增大,使料液中的c(H+)减小,促使Zn2++4HA![]() ZnA2·2HA+2H+向右进行,锌的萃取率增大。
ZnA2·2HA+2H+向右进行,锌的萃取率增大。
②“滤液4”中加入有机萃取剂将Zn2+萃取,出现分层现象,将有机层与水层分离的“操作X”的名称为分液。
(6)根据Ni守恒,Ni的回收率为![]() 100%=95.4%。
100%=95.4%。

 经典密卷系列答案
经典密卷系列答案 金牌课堂练系列答案
金牌课堂练系列答案 三新快车金牌周周练系列答案
三新快车金牌周周练系列答案