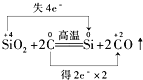
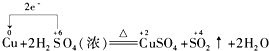题目内容
【题目】对于可逆反应3H2+N22NH3 , 下列措施能使反应物中活化分子百分数、化学反应速率和化学平衡常数都变化的是( )
A.使用高效催化剂
B.充入更多N2
C.降低温度
D.增大压强
【答案】C
【解析】解:A.使用催化剂,平衡常数不变,故A错误;
B.多充N2,活化分子百分数、平衡常数不变,故B错误;
C.降低温度,反应物中活化分子百分数、化学反应速率都减小,且化学平衡常数发生变化,故C正确;
D.增大压强,活化分子百分数不变,平衡常数不变,故D错误.
故选C.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
【题目】用NaOH标准溶液对某醋酸溶液的浓度进行标定。回答下列问题:
(1)实验用品有:0.2000 mol/L的NaOH溶液,醋酸溶液,蒸馏水;pH计,酸式滴定管,碱式滴定管,锥形瓶,烧杯,铁架台。还缺少的一种仪器是____________。
(2)为标定该醋酸溶液的准确浓度,用0.2000 mol/L的NaOH溶液对20.00 mL醋酸溶液进行滴定,几次滴定消耗NaOH溶液的体积如下:
实验序号 | 1 | 2 | 3 |
消耗NaOH溶液的体积(mL) | 20.05 | 20.00 | 19.95 |
该醋酸溶液的准确浓度为_____________(保留小数点后四位),上述标定过程中,造成测定结果偏高的原因可能是_______________。
A.未用标准液润洗碱式滴定管
B.滴定终点读数时,俯视滴定管的刻度,其它操作均正确
C.盛装未知液的锥形瓶用蒸馏水洗过,未用待测液润洗
D.滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液