题目内容
【题目】锌与浓硫酸反应,随着硫酸的浓度下降,产生的气体中混有H2,为证实相关分析,化学小组的同学设计了如图所示的实验装置,对反应后的气体(X)取样进行组分分析(遇有气体吸收过程,视为完全吸收)。
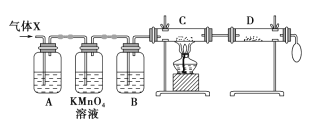
(1)A中加入的试剂可能是_________,KMnO4 溶液的作用是_________,若高锰酸钾溶液与B 之间不再添加装置,请描述观察到何种现象能表明已达到使用高锰酸钾溶液的目的_______________。
(2)可证实气体 X 中混有较多氢气的实验现象是:C中 _____________,D中______________。
【答案】 品红溶液 吸收过量SO2 高锰酸钾溶液颜色变浅,但没有褪成无色 C中黑色粉末变红色 D中白色粉末变蓝色
【解析】锌和浓硫酸反应生成硫酸锌,二氧化硫和水,浓硫酸随反应进行浓度变小后,稀硫酸和锌反应生成氢气,因此气体X中含有二氧化硫和氢气。因二氧化硫具有漂白性,所以A中加入的试剂可能是品红试液,作用是检验SO2的存在;酸性高锰酸钾溶液的目的是吸收生成的二氧化硫气体,则B装置中加浓硫酸吸收气体中的水分,装置C将残留的气体通过灼热的氧化铜反应,目的是验证该气体具有还原性,装置D无水硫酸铜检验水,若变蓝色则C装置反应生成水。
(1)根据上述分析,A中加入的试剂可能是品红试液;酸性高锰酸钾溶液的目的是吸收过量的二氧化硫气体,若高锰酸钾溶液与B 之间不再添加装置,应该看到高锰酸钾溶液颜色变浅,但没有褪成无色,说明二氧化硫全部纯净,故答案为:品红溶液;吸收过量SO2;高锰酸钾溶液颜色变浅,但没有褪成无色;
(2)由以上分析得,装置C中所装药品为CuO;若看到C中黑色粉末变为红色,D中的白色固体变为蓝色,可以证实气体X中混有较多的氢气,故答案为:C中黑色粉末变红色;D中白色粉末变蓝色。