题目内容
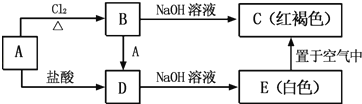
【题目】利用废旧镀锌铁皮(含Fe、Zn、Fe2O3、ZnO)制备纳米Fe3O4及副产物ZnO的流程如下:
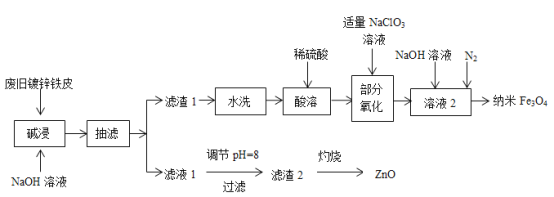
已知:Zn及其化合物的性质与Al及其化合物的性质相似,“滤液1”中锌元素以ZnO22-形式存在。回答下列问题:
(1)实验中需调节“滤液1”的pH约为8,pH过大或过小都不利的原因是_______________。
(2)“滤渣1”的主要成分是__________(填化学式,下同),“滤渣2”的主要成分是_______。
(3)“部分氧化”阶段,ClO3-被还原为Cl-,该反应的离子方程式是____________________。
(4)向“溶液2”中通入N2的目的是________________________________________________。
(5)某化学兴趣小组用m1 g废旧镀锌铁皮(Fe元素的质量分数为w)制备纳米Fe3O4,最终得到m2 g产品,则产率为__________(用含m1、m2和w的代数式表示)。
(6)用酸性高锰酸钾溶液可测定产物Fe3O4中二价铁含量,用稀硫酸溶解Fe3O4,再用酸性KMnO4标准溶液进行滴定,发生反应:5Fe2++MnO4-+8H+=Mn2++5Fe3++4H2O。
①判断该反应到达滴定终点的现象是______________________________________________。
②滴定操作中,若滴定前装有酸性KMnO4标准溶液的滴定管尖嘴部分无气泡,而滴定结束后有气泡,则测得的二价铁含量__________(填“偏高”偏低”或“无影响”)。
【答案】pH过小,导致氢氧化锌沉淀溶解;pH过大,ZnO22-不会完全转化为Zn(OH)2,ZnO的产率减小 Fe、Fe2O3 Zn(OH)2 6Fe2++ClO3-+6H+=6Fe3++Cl-+3H2O 防止Fe2+被氧化 ![]() 当滴入最后一滴KMnO4溶液时,溶液由淡黄色变成浅红色,且半分钟内不褪色 偏低
当滴入最后一滴KMnO4溶液时,溶液由淡黄色变成浅红色,且半分钟内不褪色 偏低
【解析】
由流程图可知,废旧镀锌铁皮(含Fe、Zn、Fe2O3、ZnO)加NaOH后,Zn、ZnO转化为ZnO22-,进入滤液1中,Fe2O3、Fe不与NaOH反应,进入到滤渣1中。滤渣1经水洗、酸溶,转化为含有Fe2+和Fe3+的溶液,加入NaClO3氧化,使部分Fe2+转化为Fe3+,再加入NaOH,在N2的保护下使Fe2+和Fe3+转化为纳米Fe3O4。滤液调pH后ZnO22-转化为Zn(OH)2沉淀下来,滤渣2即为Zn(OH)2,经灼烧后转化为ZnO。
(1)根据分析,滤液1中为ZnO22-,pH过小,会导致Zn(OH)2沉淀溶解:Zn(OH)2+2H+=Zn2++2H2O;由于ZnO22-在强碱中可稳定存在,pH过大,ZnO22-不会完全转化为Zn(OH)2,最终生成的ZnO减少;
(2)由分析可知,滤渣1的主要成分是Fe、Fe2O3,滤渣2的主要成分是Zn(OH)2;
(3)部分氧化过程中,Fe2+被氧化为Fe3+,根据题意,ClO3-被还原为Cl-,故离子方程式为:6Fe2++ClO3-+6H+=6Fe3++Cl-+3H2O;
(4)由于部分氧化之后,溶液中的Fe2+和Fe3+已经符合纳米Fe3O4要求的比例,而在加NaOH的过程中,Fe2+易被氧化,故通N2的目的是防止Fe2+被氧化;
(5)Fe3O4中Fe占的比例为![]() ,m1 g废旧镀锌铁皮(Fe元素的质量分数为w)理论上能产生Fe3O4的质量为
,m1 g废旧镀锌铁皮(Fe元素的质量分数为w)理论上能产生Fe3O4的质量为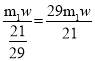 ,最终得到m2 g产品,则产率为
,最终得到m2 g产品,则产率为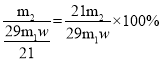 ;
;
(6)①用酸性KMnO4溶液可测定产物Fe3O4中的Fe2+,由于原溶液中既有Fe2+又有Fe3+,故原溶液为黄色,当Fe2+被滴定完后,溶液中出现KMnO4,溶液变为浅红色,所以滴定终点现象为:当滴入最后一滴KMnO4溶液时,溶液由淡黄色变成浅红色,且半分钟内不褪色。
②若滴定前装有酸性KMnO4标准溶液的滴定管尖嘴部分无气泡,而滴定结束后有气泡,说明滴定使用的KMnO4标准溶液体积偏小,导致计算时算出的Fe2+含量也偏小。