题目内容
11.图中A~J均为中学化学常见的物质,它们之间有如下转化关系.其中A、D为金属单质,B 为红棕色氧化物.(反应过程中生成的水及其他产物已略去)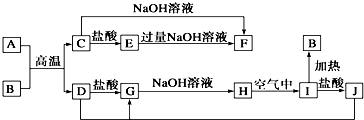
请回答以下问题:
(1)F是NaAlO2,H是Fe(OH)2;(填化学式)
(2)写出J与D反应转化为G的离子方程式:2Fe3++Fe=3Fe2+;
(3)写出A与B反应的化学方程式:2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$Al2O3+2Fe.
分析 A、D为金属单质,B 为红棕色氧化物,B为Fe2O3,所以A与B的反应为铝热反应,则A为Al,C能与酸和碱反应,所以C为Al2O3,D为Fe,结合转化关系可知,E为AlCl3,F为NaAlO2,G为FeCl2,H为Fe(OH)2,I为Fe(OH)3,J为FeCl3,然后结合物质的性质及化学用语来解答.
解答 解:A、D为金属单质,B 为红棕色氧化物,B为Fe2O3,所以A与B的反应为铝热反应,则A为Al,C能与酸和碱反应,所以C为Al2O3,D为Fe,结合转化关系可知,E为AlCl3,F为NaAlO2,G为FeCl2,H为Fe(OH)2,I为Fe(OH)3,J为FeCl3,
(1)由上述分析可知,F为NaAlO2,H为Fe(OH)2,
故答案为:NaAlO2;Fe(OH)2;
(2)J与D反应转化为G的离子方程式为2Fe3++Fe=3Fe2+,
故答案为:2Fe3++Fe=3Fe2+;
(3)A和B的反应的化学方程式为2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$Al2O3+2Fe,
故答案为:2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$Al2O3+2Fe.
点评 本题考查无机物的推断,为高频考点,综合考查元素化合物知识,把握铝热反应及两性化合物的性质为解答的关键,侧重Al、Fe及其化合物之间转化反应的考查,题目难度不大.

练习册系列答案
相关题目
1.$\stackrel{131}{53}$I是人工合成的,常用于医疗上放射性诊断,下列有关说法正确的是( )
| A. | $\stackrel{131}{53}$I核内的中子数比质子数多25个 | |
| B. | $\stackrel{131}{53}$I和$\stackrel{127}{53}$I都是自然界稳定存在的碘元素的同位素 | |
| C. | $\stackrel{131}{53}$I2和$\stackrel{127}{53}$I2互为同素异形体 | |
| D. | $\stackrel{131}{53}$I2可制成药物用于治疗甲状腺肿大 |
2.下列说法正确的是( )
| A. | 两种元素构成的共价化合物分子中的化学键一定都是极性键 | |
| B. | 离子化合物中可以含有共价键,但共价化合物中一定不含离子键 | |
| C. | 非金属元素组成的化合物一定是共价化合物 | |
| D. | 非极性分子中,一定含有非极性键 |
19.下列变化不会破坏化学键的是( )
| A. | 高温煅烧石灰石 | B. | 干冰气化 | ||
| C. | 氢气在氯气中燃烧 | D. | 氯化氢溶于水 |
6.下列离子方程式正确的是( )
| A. | Al(OH)3与稀盐酸反应:Al(OH)3+3H+═Al3++3H2O | |
| B. | AlCl3溶液中加入过量NH3•H2O:Al3++3OH-═Al(OH)3↓ | |
| C. | Al2(SO4)3溶液中加入少量Ba(OH)2溶液:Ba2++SO42-═BaSO4↓ | |
| D. | NaAlO2溶液中加入少量稀H2SO4溶液:AlO2-+4H+═Al3++4H2O |
16.用NA表示阿伏加德罗常数的值.下列判断正确的是( )
| A. | 46 g NO2含有氧原子数为2NA | |
| B. | 常温常压下,22.4 L N2含有的分子数为NA | |
| C. | 1 L 1 mol•L-1 Al2(SO4)3溶液中含SO${\;}_{4}^{2-}$数目为NA | |
| D. | 1 mol Fe在足量Cl2中燃烧,转移电子数为2NA |
3.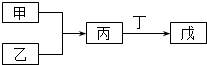 甲、乙、丙、丁、戊五种物质是中学化学常见的物质,其中甲、乙均为单质,它们的转化关系如图所示(某些条件和部分产物已略去).下列说法正确的是( )
甲、乙、丙、丁、戊五种物质是中学化学常见的物质,其中甲、乙均为单质,它们的转化关系如图所示(某些条件和部分产物已略去).下列说法正确的是( )
 甲、乙、丙、丁、戊五种物质是中学化学常见的物质,其中甲、乙均为单质,它们的转化关系如图所示(某些条件和部分产物已略去).下列说法正确的是( )
甲、乙、丙、丁、戊五种物质是中学化学常见的物质,其中甲、乙均为单质,它们的转化关系如图所示(某些条件和部分产物已略去).下列说法正确的是( )| A. | 若甲可以与NaOH溶液反应放出H2,则丙一定是两性氧化物 | |
| B. | 若甲为短周期中最活泼的金属,且戊为碱,则丙生成戊一定是氧化还原反应 | |
| C. | 若丙、丁混合产生大量白烟,则乙可能具有漂白性 | |
| D. | 若甲、丙、戊都含有同一种元素,则三种物质中,该元素的化合价由低到高的顺序可能为甲<丙<戊 |
 CO3;③三个钙原子3Ca.
CO3;③三个钙原子3Ca.