题目内容
1.美国化学家鲍林教授具有独特的化学想象力:只要给他物质的分子式,他就能大体上想象出这种物质的分子结构模型.多核离子所带电荷可以认为是中心原子得失电子所致,根据VSEPR模型,下列离子中所有原子都在同一平面上的一组是C.A、NO2-和NH4+B、H3O+和ClO3-C、NO3-和CO32-D、PO43-和SO42-.
分析 离子中所有原子都在同一平面上,则离子的空间构型为直线形、V形或平面三角形,根据中心原子的价层电子对数判断分子的空间构型,价层电子对=σ 键电子对+中心原子上的孤电子对,据此分析.
解答 解:A、NO2-中心原子的价层电子对数=2+$\frac{1}{2}$(5+1-2×2)=3,含有一个孤电子对,空间构型为V形,NH4+中心原子的价层电子对数=4+$\frac{1}{2}$(5-1-4×1)=4,没有孤电子对,空间构型为正四面体,故A不选;
B、H3O+中心原子的价层电子对数=3+$\frac{1}{2}$(6-1-3×1)=4,含有一个孤电子对,空间构型为三角锥形,ClO3-中心原子的价层电子对数=3+$\frac{1}{2}$(7+1-3×2)=4,含有一个孤电子对,空间构型为三角锥形,故B不选;
C、NO3-中心原子的价层电子对数=3+$\frac{1}{2}$(5+1-3×2)=3,没有孤电子对,空间构型为平面三角形,CO32-中心原子的价层电子对数=3+$\frac{1}{2}$(4+2-2×3)=3,没有孤电子对,空间构型为平面三角形,故C选;
D、PO43-中心原子的价层电子对数=4+$\frac{1}{2}$(5+3-4×2)=4,没有孤电子对,空间构型为正四面体,SO42-中心原子的价层电子对数=4+$\frac{1}{2}$(6+2-4×2)=4,没有孤电子对,空间构型为正四面体,故D不选.
故选C.
点评 本题考查了离子的立体构型的判断,侧重考查杂化轨道理论的理解应用,把握常见分子或离子中原子的杂化及空间构型的判断方法为解答的关键,题目难度中等.

练习册系列答案
 王后雄学案教材完全解读系列答案
王后雄学案教材完全解读系列答案 海淀课时新作业金榜卷系列答案
海淀课时新作业金榜卷系列答案
相关题目
12.在TiCl3的饱溶液中通入HCl至饱和,再加入乙醚生成绿色晶体,如果不加入乙醚,直接通入HCl得到的是紫色晶体,已知两种晶体分子式均为TiCl3•6H2O,配位数都是6的配合物,分别取0.01mol两种晶在水溶液中用过量AgNO3处理,绿色晶体得到的白色沉淀质量为紫色晶体得到沉淀质量的2/3,则下列有关说法不正确的是( )
| A. | 该绿色晶体配体是氯离子和水,它们物质的量之比为1:5 | |
| B. | 紫色晶体配合物的化学式为[Ti(H2O)6]Cl3 | |
| C. | 上述两种晶体的分子式相同,但结构不同,所以性质不同 | |
| D. | 0.01mol 紫色晶体在水溶液中与过量AgNO3作用最多可得到 2.78 g 沉淀 |
16.有关SO2的性质,下列说法不正确的是( )
| A. | 能使品红溶液褪色 | B. | 能与NaOH溶液反应 | ||
| C. | 能与H2O反应生成H2SO4 | D. | 一定条件下能与O2反应生成SO3 |
6.某同学按如下实验流程提取海带中的碘,下列有关说法正确的是( )
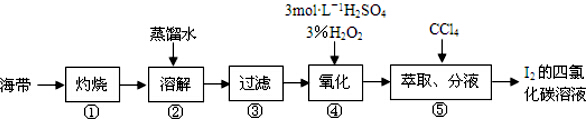

| A. | 第③步所需的主要玻璃仪器有:玻璃棒、烧杯、分液漏斗 | |
| B. | 第④步的离子反应方程式:H2O2+2I-+2H+=I2+2H2O | |
| C. | 第⑤步的CCl4可换成苯或酒精 | |
| D. | 该流程中分离出的碘可直接用作“加碘”食盐的碘添加剂 |
13.下列说法正确的是( )
| A. | 在101kPa时,1mol物质完全燃烧时所放出的热量,叫做该物质的燃烧热 | |
| B. | 热化学方程式各物质前的化学计量数只表示分子个数不代表物质的量 | |
| C. | 燃烧热或中和热是反应热的种类之一 | |
| D. | 对于H2+Cl2$\frac{\underline{\;点燃\;}}{\;}$2HCl△H<0,断开1mol H-H键和1mol Cl-Cl键所吸收的总能量大于形成2mol H-Cl键所放出的能量 |
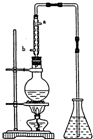 市售乙醛通常为40%左右的乙醛溶液.久置的乙醛溶液会产生分层现象,上层为无色油状液体,下层为水溶液.据测定,上层物质为乙醛的加合物(C2H4O)n,它的沸点比水的沸点高,分子中无醛基.乙醛在溶液中易被氧化,为从变质的乙醛溶液中提取乙醛(仍得到溶液),可利用如下反应原理:(C2H4O)n$\stackrel{{H}^{+}}{→}$ n(C2H4O)
市售乙醛通常为40%左右的乙醛溶液.久置的乙醛溶液会产生分层现象,上层为无色油状液体,下层为水溶液.据测定,上层物质为乙醛的加合物(C2H4O)n,它的沸点比水的沸点高,分子中无醛基.乙醛在溶液中易被氧化,为从变质的乙醛溶液中提取乙醛(仍得到溶液),可利用如下反应原理:(C2H4O)n$\stackrel{{H}^{+}}{→}$ n(C2H4O) .
.