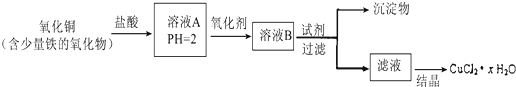
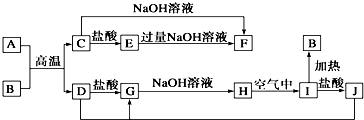
题目内容
2.下列说法正确的是( )| A. | 两种元素构成的共价化合物分子中的化学键一定都是极性键 | |
| B. | 离子化合物中可以含有共价键,但共价化合物中一定不含离子键 | |
| C. | 非金属元素组成的化合物一定是共价化合物 | |
| D. | 非极性分子中,一定含有非极性键 |
分析 A.由两种元素构成的共价化合物分子的化学键可能含有非极性键;
B.含有离子键的化合物属于离子化合物,只含有共价键的化合物属于共价化合物;
C.铵盐属于由非金属元素组成的离子化合物;
D.分子结构对称,正负电荷中心重叠的分子属于非极性分子.
解答 解:A.由两种元素构成的共价化合物分子的化学键可能含有非极性键,如碳原子数超过1个的烃类化合物,故A错误;
B.含有离子键的化合物属于离子化合物,离子化合物中可能含有共价键,如如Na2O2,只含有共价键的化合物属于共价化合物,共价化合物中一定不含离子键,故B正确;
C.铵盐属于由非金属元素组成的离子化合物,所以非金属元素组成的化合物不一定是共价化合物,故C错误;
D.分子结构对称,正负电荷中心重叠的分子属于非极性分子,如甲烷属于非极性分子,分子中只有C-H极性键,故D错误.
故选B.
点评 本题考查了化学键和化合物的关系,明确离子键和共价键的概念是解本题关键,采用反例法来分析解答,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
12.可与Ba(OH)2(固态)、CuSO4(固态)、纯CH3COOH三种物质归于一类的物质是( )
| A. | C2H5OH(水溶液) | B. | 盐酸 | C. | 水煤气 | D. | 烧碱 |
10.铁与一定量浓硝酸加热反应,得到硝酸铁溶液和NO2、N2O4、NO的混合气体,这些气体与4.48L O2(标准状况)混合后通入水中,所有气体完全被水吸收生成硝酸.则消耗铁的质量约为( )
| A. | 15 g | B. | 22.4 g | C. | 28 g | D. | 无法计算 |
7.下列离子方程式书写正确的是( )
| A. | 铁与氯化铁溶液反应:Fe+Fe3+═2Fe2+ | |
| B. | 钠与水反应:Na+H2O═Na++OH-+H2↑ | |
| C. | 稀硫酸与氢氧化钡溶液反应:H++OH-═H2O | |
| D. | 铝与氢氧化钠溶液反应:2Al+2OH-+6H2O═2[Al(OH)4]-+3H2↑ |
14.下列关于复合材料的说法中不正确的是( )
| A. | 复合材料由基体和增强体组成,其中基体起骨架作用,增强体起黏结作用 | |
| B. | 玻璃钢是玻璃纤维增强树脂,具有很好的耐腐蚀性,在排水工程中有广泛应用 | |
| C. | 碳纤维增强金属基复合材料具有很高的强度,可用于制作飞机的机翼和机身 | |
| D. | 碳纤维增强陶瓷保持了陶瓷的耐高温的特性,可用于飞机机身的隔热材料 |
12.在TiCl3的饱溶液中通入HCl至饱和,再加入乙醚生成绿色晶体,如果不加入乙醚,直接通入HCl得到的是紫色晶体,已知两种晶体分子式均为TiCl3•6H2O,配位数都是6的配合物,分别取0.01mol两种晶在水溶液中用过量AgNO3处理,绿色晶体得到的白色沉淀质量为紫色晶体得到沉淀质量的2/3,则下列有关说法不正确的是( )
| A. | 该绿色晶体配体是氯离子和水,它们物质的量之比为1:5 | |
| B. | 紫色晶体配合物的化学式为[Ti(H2O)6]Cl3 | |
| C. | 上述两种晶体的分子式相同,但结构不同,所以性质不同 | |
| D. | 0.01mol 紫色晶体在水溶液中与过量AgNO3作用最多可得到 2.78 g 沉淀 |