题目内容
20.用化学符号填空:①氯化亚铁中的阳离子Fe2+;②标出碳酸钡中钡元素的化合价 CO3;③三个钙原子3Ca.
CO3;③三个钙原子3Ca.
分析 ①根据离子的表示方法:在表示该离子的元素符号右上角,标出该离子所带的正负电荷数,数字在前,正负符号在后,带1个电荷时,1要省略.若表示多个该离子,就在其元素符号前加上相应的数字;
②元素化合价的表示方法:确定出化合物中所要标出的元素的化合价,然后在其化学式该元素的上方用正负号和数字表示,正负号在前,数字在后;
③原子的表示方法就是用元素符号来表示一个原子,表示多个该原子,就在其元素符号前加上相应的数字.
解答 解:①氯化亚铁中的阳离子为亚铁离子表示为:Fe2+,故答案为:Fe2+;
②标出碳酸钡中钡元素的化合价,故可表示为: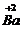
③三个钙原子,就可表示为:3Ca,故答案为:3Ca.
点评 本题主要考查化学用语的书写和理解能力,题目设计既包含对化学符号意义的了解,又考查了学生对化学符号的书写,考查全面,注重基础,题目难度不大.

练习册系列答案
相关题目
10.铁与一定量浓硝酸加热反应,得到硝酸铁溶液和NO2、N2O4、NO的混合气体,这些气体与4.48L O2(标准状况)混合后通入水中,所有气体完全被水吸收生成硝酸.则消耗铁的质量约为( )
| A. | 15 g | B. | 22.4 g | C. | 28 g | D. | 无法计算 |
5.下列关于σ键和π键的理解不正确的是( )
| A. | 共价单键都是σ键,共价双键中有一个σ键和一个π键 | |
| B. | σ键可以绕键轴旋转,π键一定不能绕键轴旋转 | |
| C. | H2 分子中的σ键是s-s σ键,HClO分子中的σ键是p-p σ键 | |
| D. | C2H4分子中有5个σ键和一个π键,N2H4中只有5个σ键 |
12.在TiCl3的饱溶液中通入HCl至饱和,再加入乙醚生成绿色晶体,如果不加入乙醚,直接通入HCl得到的是紫色晶体,已知两种晶体分子式均为TiCl3•6H2O,配位数都是6的配合物,分别取0.01mol两种晶在水溶液中用过量AgNO3处理,绿色晶体得到的白色沉淀质量为紫色晶体得到沉淀质量的2/3,则下列有关说法不正确的是( )
| A. | 该绿色晶体配体是氯离子和水,它们物质的量之比为1:5 | |
| B. | 紫色晶体配合物的化学式为[Ti(H2O)6]Cl3 | |
| C. | 上述两种晶体的分子式相同,但结构不同,所以性质不同 | |
| D. | 0.01mol 紫色晶体在水溶液中与过量AgNO3作用最多可得到 2.78 g 沉淀 |


 .
. .
. .
. .
.