题目内容
16.用NA表示阿伏加德罗常数的值.下列判断正确的是( )| A. | 46 g NO2含有氧原子数为2NA | |
| B. | 常温常压下,22.4 L N2含有的分子数为NA | |
| C. | 1 L 1 mol•L-1 Al2(SO4)3溶液中含SO${\;}_{4}^{2-}$数目为NA | |
| D. | 1 mol Fe在足量Cl2中燃烧,转移电子数为2NA |
分析 A、求出二氧化氮的物质的量,然后根据1mol二氧化氮中含2mol氧原子来分析;
B、常温常压下,气体摩尔体积大于22.4L/mol;
C、求出硫酸铝的物质的量n=CV,然后根据1mol硫酸铝中含3mol硫酸根来计算;
D、铁在氯气中燃烧后变为+3价.
解答 解:A、46g二氧化氮的物质的量为1mol,而1mol二氧化氮中含2mol氧原子,即2NA个,故A正确;
B、常温常压下,气体摩尔体积大于22.4L/mol,故22.4L氮气的物质的量小于1mol,则分子数小于NA个,故B错误;
C、溶液中硫酸铝的物质的量n=CV=1mol/L×1L=1mol,而1mol硫酸铝中含3mol硫酸根即3NA个,故C错误;
D、铁在氯气中燃烧后变为+3价,故1mol铁和氯气反应后转移3mol电子即3NA个,故D错误.
故选A.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案
相关题目
6.设NA为阿伏加德罗常数的值.下列说法正确的是( )
| A. | 一定条件下,0.1molSO2与足量氧气反应生成SO3,转移电子数为0.2NA | |
| B. | 标准状况下,20gD2O分子中所含中子数为10NA | |
| C. | 标准状况下,22.4LCl2完全溶于水时形成氯水时,转移电子数为NA | |
| D. | 氢氧燃料电池正极消耗22.4L气体时,电路中通过的电子数目为4NA |
7.下列离子方程式书写正确的是( )
| A. | 铁与氯化铁溶液反应:Fe+Fe3+═2Fe2+ | |
| B. | 钠与水反应:Na+H2O═Na++OH-+H2↑ | |
| C. | 稀硫酸与氢氧化钡溶液反应:H++OH-═H2O | |
| D. | 铝与氢氧化钠溶液反应:2Al+2OH-+6H2O═2[Al(OH)4]-+3H2↑ |
4.下列化学反应能设计成原电池的是( )
| A. | CaCO3+2HCl═CaCl2+H2O+CO2↑ | B. | BaCl2+Na2SO4═2NaCl+BaSO4↓ | ||
| C. | 2NaOH+CO2═Na2CO3+H2O | D. | Zn+CuSO4═ZnSO4+Cu |
1.下列实验装置正确的是( )
| A. |  实验室制乙烯 | B. |  酯化反应 | ||
| C. |  实验室制取Cl2 | D. |  中和热的测定 |
5.下列关于σ键和π键的理解不正确的是( )
| A. | 共价单键都是σ键,共价双键中有一个σ键和一个π键 | |
| B. | σ键可以绕键轴旋转,π键一定不能绕键轴旋转 | |
| C. | H2 分子中的σ键是s-s σ键,HClO分子中的σ键是p-p σ键 | |
| D. | C2H4分子中有5个σ键和一个π键,N2H4中只有5个σ键 |
6.某同学按如下实验流程提取海带中的碘,下列有关说法正确的是( )


| A. | 第③步所需的主要玻璃仪器有:玻璃棒、烧杯、分液漏斗 | |
| B. | 第④步的离子反应方程式:H2O2+2I-+2H+=I2+2H2O | |
| C. | 第⑤步的CCl4可换成苯或酒精 | |
| D. | 该流程中分离出的碘可直接用作“加碘”食盐的碘添加剂 |

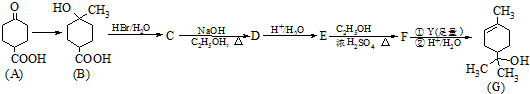
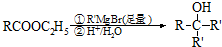
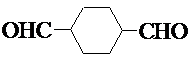 .
.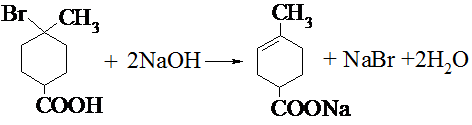 .
. .
. .
.