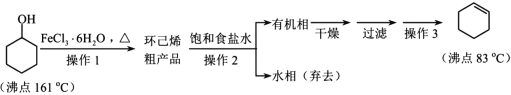
题目内容
【题目】如图的各方框表示一种反应物或生成物(某些物质已经略去),其中常温下A、C、D为无色气体,C能使湿润的红色石蕊试纸变蓝。

(1)写出物质X的化学式:__。
(2)写出下列变化的化学方程式:
①A→D:___;
②G→E:___;
③F→G:___。
(3)实验室里,常用加热固体混合物的方法制取气体C,请写出化学方程式:___。
【答案】NH4HCO3(或(NH4)2CO3) 2Na2O2+2CO2=2Na2CO3+O2 3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O 3NO2+H2O=2HNO3+NO 2NH4Cl+Ca(OH)2![]() CaCl2+2NH3↑+2H2O
CaCl2+2NH3↑+2H2O
【解析】
和过氧化钠反应的气体是二氧化碳气体,生成氧气,氧气与C在催化剂作用下反应,说明C为氨气,E为一氧化氮,F为二氧化氮,G为硝酸,B为水蒸气。
⑴根据X分解得到水、二氧化碳、氨气得出X可能为NH4HCO3(或(NH4)2CO3),故答案为NH4HCO3(或(NH4)2CO3)。
⑵①A→D是过氧化钠和水的反应,其方程式为2Na2O2+2CO2=2Na2CO3+O2,故答案为:2Na2O2+2CO2=2Na2CO3+O2。
②G→E是铜和硝酸的反应,其方程式为3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O,故答案为:3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O。
③F→G是二氧化氮和水的反应,其方程式为3NO2+H2O=2HNO3+NO,故答案为:3NO2+H2O=2HNO3+NO。
⑶实验室里常用加热氯化铵和氢氧化钙固体混合物的方法制取气体C,其化学方程式:2NH4Cl+Ca(OH)2![]() CaCl2+2NH3↑+2H2O,故答案为:2NH4Cl+Ca(OH)2
CaCl2+2NH3↑+2H2O,故答案为:2NH4Cl+Ca(OH)2![]() CaCl2+2NH3↑+2H2O。
CaCl2+2NH3↑+2H2O。

 数学奥赛暑假天天练南京大学出版社系列答案
数学奥赛暑假天天练南京大学出版社系列答案 南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案
南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案【题目】已知2SO2(g)+O2(g)![]() 2SO3(g),如图为不同温度(T1、T2)下SO2的转化率随时间的变化曲线。
2SO3(g),如图为不同温度(T1、T2)下SO2的转化率随时间的变化曲线。
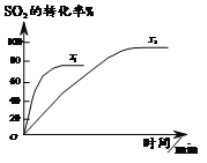
完成下列填空:
(1)T1__________(选填“>”“<”或“=”)T2,判断依据是_______________;该反应为___________(选填“放”或“吸”)热反应,判断依据是__________。
(2)下表为一定温度和压强下,4种投料比[n(SO2):n(O2)]分别为2:18、4:15、7:11和8:10时SO2的平衡转化率。
投料比 | ① | ② | ③ | ④ |
SO2平衡转化率/% | 97.1 | 96.8 | 95.8 | 90.0 |
②对应的投料比为_____。投料比为8:10时,平衡混合气体中SO3体积分数为______。
(3)在相同温度下:2NO(g)+O2(g)![]() 2NO2(g) K1=a;NO2(g)+SO2(g)
2NO2(g) K1=a;NO2(g)+SO2(g)![]() SO3(g)+NO(g) K2=b;则2SO2(g)+O2(g)
SO3(g)+NO(g) K2=b;则2SO2(g)+O2(g)![]() 2SO3(g) 的平衡常数K=__________(用a、b表示)。
2SO3(g) 的平衡常数K=__________(用a、b表示)。
(4)钠碱循环法吸收硫酸厂尾气中的SO2并将其转化为硫酸的工艺如下:

吸收池中发生反应的离子方程式是________;NaHSO3溶液呈弱酸性,NaHSO3溶液中离子浓度由大到小排序为_________。