题目内容
【题目】为研究金属腐蚀的条件和速率,某课外小组的学生用金属丝将三根大小相同的铁钉分别固定在图示的三个装置中,再放置于玻璃钟罩里,保存一星期后,下列有关实验现象的描述不正确的是( )
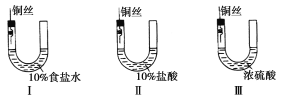
A.装置Ⅰ中左侧液面一定会上升
B.装置Ⅰ中左侧液面比装置Ⅱ中低
C.装置Ⅱ中的铁钉腐蚀最严重
D.装置Ⅲ中的铁钉几乎没被腐蚀
【答案】B
【解析】
A.Ⅰ中铁钉中含有杂质C,C、Fe和水蒸气构成原电池,发生吸氧腐蚀,所以I中左侧压强减小,液面上升,故A正确;
B.盐酸具有挥发性,所以II中左侧空气中含有稀盐酸,导致II发生析氢腐蚀,发生了反应为2H++2e-=H2↑,生成了气体,则Ⅱ中左侧液面会下降,即左侧液面装置Ⅱ比装置Ⅰ低,故B错误;
C.Ⅰ中铁钉中含有杂质C,C、Fe和水蒸气构成原电池,发生吸氧腐蚀;Ⅱ中铁丝与铜丝相连,金属活泼性相差较大,且用挥发性盐酸,构成电化学腐蚀;Ⅲ中虽然铁钉也和铜丝相连,但由于所装试剂为不挥发性硫酸,且浓硫酸具有吸水性,铁钉在干燥的空气中几乎不被腐蚀;因此Ⅱ中的铁丝腐蚀最严重,故C正确;
D.Ⅲ中虽然铁钉也和铜丝相连,但由于所装试剂为不挥发性硫酸,且浓硫酸具有吸水性,铁钉在干燥的空气中几乎不被腐蚀,故D正确;
故选B。

【题目】利用CH4可消除NO2的污染,反应原理为:CH4(g)+2NO2(g) N2(g) + CO2(g) +2H2O(g),在10L密闭容器中分别加入0.50mol CH4 和1.2mol NO2,测得不同温度下 n(CH4)随时间变化的有关实验数据如表所示,下列说法正确的是
组别 | 温度/K | 时间/min 物质的量/mol | 0 | 10 | 20 | 40 | 50 |
① | T1 | n(CH4) | 0.50 | 0.35 | 0.25 | 0.10 | 0.10 |
② | T2 | n(CH4) | 0.50 | 0.30 | 0.18 | M | 0.15 |
A.由实验数据可知温度 T 1<T2
B.组别①中 0 ~20 min 内,NO2 降解速率为0.0125 molL-1min-1
C.40 min 时,表格中 M 对应的数据为 0.18
D.该反应只有在高温下才能自发进行
【题目】由下列实验及现象不能推出相应结论的是
实验 | 现象 | 结论 | |
A | 向2mL0.1mol·L-1的FeCl3溶液中加足量铁粉,振荡,加1滴KSCN溶液 | 黄色逐期消失,加KSCN溶液颜色不变 | 还原性:Fe>Fe2+ |
B | 将金属钠在燃烧匙中点燃,迅速伸入集满CO2的集气瓶 | 集气瓶中产生大量白烟,瓶内有黑色颗粒产生 | CO2具有氧化性 |
C | 加热盛有少NH4HCO3固体的试管,并在试管口放置湿润的红色石蕊试纸 | 石蕊试纸变蓝 | NH4HCO3显碱性 |
D | 向2支盛有2mL相同浓度银氨溶液的试管中分别加入2滴相同浓度的NaCl和NaI溶液 | 一只试管中产生黄色沉淀,另一支中无明显现象 | Ksp(AgI)<Ksp(AgCl) |
A. A B. B C. C D. D