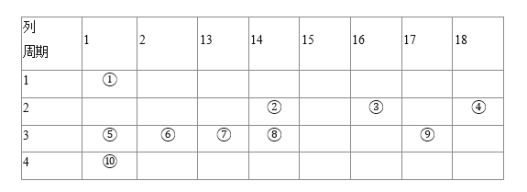
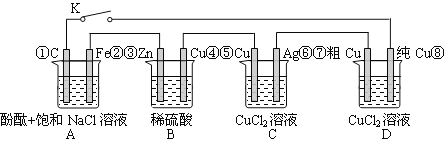
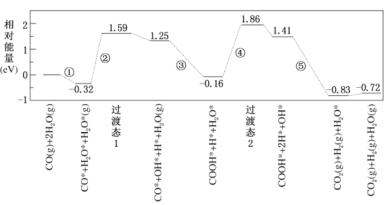
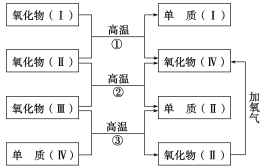
题目内容
【题目】下列指定反应的离子方程式正确的是
A.将铜丝插入稀硝酸中:Cu+4H++2![]() =Cu2++2NO2↑+2H2O
=Cu2++2NO2↑+2H2O
B.漂白粉溶液中通入少量SO2:Ca2++2ClO-+SO2+H2O=CaSO3↓+2HClO
C.硫酸铜溶液与过量的氨水反应:Cu2++4NH3H2O=[Cu(NH3)4]2++4H2O
D.用惰性电极电解MgCl2溶液:2Cl-+2H2O![]() H2↑+Cl2↑+2OH-
H2↑+Cl2↑+2OH-
【答案】C
【解析】
A.Cu与稀硝酸反应生成NO而不是NO2,该离子方程式不符合客观事实,正确的离子方程式为:3Cu+8H++2![]() =3Cu2++2NO↑+4H2O,A项错误;
=3Cu2++2NO↑+4H2O,A项错误;
B.漂白粉溶液中通入少量SO2,ClO-具有强氧化性,会将![]() 氧化为
氧化为![]() ,正确的离子方程式为:Ca2++3ClO-+SO2+H2O=CaSO4↓+2HClO+Cl-,B项错误;
,正确的离子方程式为:Ca2++3ClO-+SO2+H2O=CaSO4↓+2HClO+Cl-,B项错误;
C.硫酸铜溶液与过量的氨水反应生成铜氨络合物,离子方程式为:Cu2++4NH3H2O=[Cu(NH3)4]2++4H2O,C项正确;
D.用惰性电极电解MgCl2溶液,根据阴阳离子放电顺序可知生成了H2、Cl2和Mg(OH)2,Mg(OH)2为沉淀,不能拆分,正确的离子方程式为:Mg2++2Cl-+2H2O![]() H2↑+Cl2↑+Mg(OH)2↓,D项错误;
H2↑+Cl2↑+Mg(OH)2↓,D项错误;
答案选C。

练习册系列答案
相关题目