题目内容
【题目】氧气、二氧化碳是最常见的气体。回答下列问题:
(1)宇航员呼吸产生的CO2用下列反应处理,实现空间站中的O2循环利用。镍催化剂反应:CO2(g)+4H2(g)![]() CH4(g)+2H2O(g)
CH4(g)+2H2O(g)
①已知H2(g)+![]() O2(g)
O2(g)![]() H2O(g)ΔH=-akJ·mol-1,
H2O(g)ΔH=-akJ·mol-1,
CH4(g)+2O2(g)![]() CO2(g)+2H2O(g)ΔH=-bkJ·mol-1。则镍催化剂反应的ΔH=____kJ·mol-1
CO2(g)+2H2O(g)ΔH=-bkJ·mol-1。则镍催化剂反应的ΔH=____kJ·mol-1
②空间站中所涉及的反应有:
a.镍催化剂反应:CO2(g)+4H2(g)![]() CH4(g)+2H2O(g)
CH4(g)+2H2O(g)
b.电解水反应:2H2O(l)=2H2(g)+O2(g)
c.模拟呼吸反应:C(s)+O2(g)=CO2(g)
则实现空间站O2循环总反应为____
(2)可用O2将HCl转化为Cl2,实现循环利用:O2(g)+4HCl(g)![]() 2Cl2(g)+2H2O(g)。将1molO2和4molHCl充入某恒容密闭容器中,分别在T1和T2的温度下进行实验,测得容器内总压强(p)与反应时间(t)的变化关系如图所示。
2Cl2(g)+2H2O(g)。将1molO2和4molHCl充入某恒容密闭容器中,分别在T1和T2的温度下进行实验,测得容器内总压强(p)与反应时间(t)的变化关系如图所示。

③该反应的速率v=kca(O2)·cb(HCl),k为速率常数),下列说法正确的是____(填标号)。
A.温度升高,k增大
B.使用催化剂,k不变
C.在容器中充入不反应的He,总压增大,k增大
D.平衡后再充入1molO2和4molHCl,k增大
④T1____T2(填“>”或“<”);T1时的转化率____T2时的转化率(填“>”“=”或“<”)。
⑤T1时,HCl的平衡转化率=____;T2反应的Kx=____(Kx为以物质的量分数表示的平衡常数)。
【答案】-4a+b C(s)+2H2(g)=CH4(g) A < > 62.5% ![]()
【解析】
(1)根据盖斯定律进行计算;通过化学反应电解水得到氧气和氢气,氧气为人类呼吸所用,氢气和与人类呼出的二氧化碳反应生成水和甲烷,然后水就又电解生成氧气,这样形成一个循环链,使空间站中的氧气量足够宇航员使用;
(2) ③A.温度改变瞬间,浓度没有影响,即通过增大k从而改变了速率;
B.催化剂降低了反应的活化能,使反应的速率常数k增大;
C.在容器中充入不反应的 He,总压增大分压不变,平衡不变,k 不变;
D.“平衡后再充入1molO2和4molHCl”,相当于增大反应体系的压强;
④根据温度对平衡移动的影响规律,结合图像进行分析;
⑤设反应的O2的物质的量为![]() ,根据反应列出三段式进行分析,根据物质的量之比等于压强之比列方程进行计算;根据平衡常数的计算公式进行计算。
,根据反应列出三段式进行分析,根据物质的量之比等于压强之比列方程进行计算;根据平衡常数的计算公式进行计算。
(1)①设反应H2(g)+![]() O2(g)
O2(g)![]() H2O(g)ΔH=-akJ·mol-1为式①,反应CH4(g)+2O2(g)
H2O(g)ΔH=-akJ·mol-1为式①,反应CH4(g)+2O2(g)![]() CO2(g)+2H2O(g)ΔH=-bkJ·mol-1为式②,反应CO2(g)+4H2(g)
CO2(g)+2H2O(g)ΔH=-bkJ·mol-1为式②,反应CO2(g)+4H2(g)![]() CH4(g)+2H2O(g)可以由②-4×①得出,故该反应的ΔH=-4a+b kJ·mol-1;
CH4(g)+2H2O(g)可以由②-4×①得出,故该反应的ΔH=-4a+b kJ·mol-1;
②由a+b+c得,C(s)+2H2(g)=CH4(g),空间站O2循环总反应为:C(s)+2H2(g)=CH4(g);
(2)③A.刚升温时c(O2)、c(HCl)都不变,升温反应速率增大,故k增大,A正确;
B.催化剂降低了反应的活化能,使反应的速率常数k增大,B错误;
C.充入不反应的He,总压增大,由于是固定容器,原物质的浓度都没变,反应速率不变,故k不变,C错误;
D.平衡后再充入1molO2和4molHCl,c(O2)、c(HCl)都增大,故反应速率增大不一定是由于k增大,D错误;
故选A。
④由图可知,T2先达到平衡,则T1<T2;T2对应的平衡时压强大,则升高温度平衡逆向移动,所以正反应为放热反应,△H<0,因此温度越低,转化率越大,故T1时的转化率大于T2时的转化率;
⑤设反应的O2的物质的量为![]() ,根据题意
,根据题意

根据物质的量之比等于压强之比,T1有![]() ,解得
,解得![]() mol,故HCl的转化率为
mol,故HCl的转化率为![]() ;T2时,有
;T2时,有![]() ,解得
,解得![]() mol,反应后总物质的量为5-
mol,反应后总物质的量为5-![]() =4.5mol,O2、HCl、Cl2、H2O的物质的量分别为0.5mol、2mol、1mol、1mol,
=4.5mol,O2、HCl、Cl2、H2O的物质的量分别为0.5mol、2mol、1mol、1mol,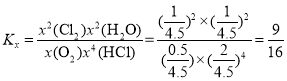

【题目】甲醇既可用于基本有机原料,又可作为燃料用于替代矿物燃料。
(1)以下是工业上合成甲醇的反应:![]()
![]() 下表所列数据是该反应在不同温度下的化学平衡常数
下表所列数据是该反应在不同温度下的化学平衡常数![]() .
.
温度 | 250℃ | 300℃ | 350℃ |
K | 2.041 | 0.270 | 0.012 |
由表中数据判断反应I为 ______ 热反应(填“吸”或“放”) ![]() 某温度下,将2molCO和6molH2充入2L的密闭容器中,充分反应,达到平衡后,测得
某温度下,将2molCO和6molH2充入2L的密闭容器中,充分反应,达到平衡后,测得![]() ,则CO的转化率为 ______ ,此时的温度为 ______ 从表中选择.
,则CO的转化率为 ______ ,此时的温度为 ______ 从表中选择.
(2)已知在常温常压下:
①![]()
②![]()
③![]()
则反应![]() ______
______ ![]() 用
用![]() 、
、![]() 、
、![]() 表示
表示
(3)处理废水时,最后![]() 以
以![]() 形式除去,当
形式除去,当![]() 时,
时,![]() 沉淀完全,此时溶液的
沉淀完全,此时溶液的![]() ______ (已知,
______ (已知,![]() ,
,![]() )
)