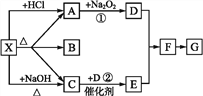
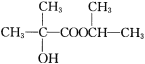
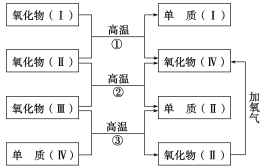
题目内容
【题目】近代化学工业的基础是“三酸两碱”,早在我国古代就已经有人通过煅烧绿矾并将产生的气体溶于水中的方法制得硫酸,该法制备硫酸的过程中发生的主要反应如下:
反应Ⅰ:2FeSO4·7H2O=Fe2O3+SO2↑+SO3↑+14H2O↑;
反应Ⅱ:SO3+H2O=H2SO4。
下列说法正确的是
A.当生成标准状况下气体22.4L时,转移1mol电子
B.6.4gSO2中所含的质子数与6.4gSO3中所含的质子数相等
C.SO2、SO3的中心原子杂化类型不同
D.目前,工业上制硫酸的吸收阶段是采用浓硫酸吸收SO3
【答案】BD
【解析】
反应Ⅰ:2FeSO4·7H2O=Fe2O3+SO2↑+SO3↑+14H2O↑是氧化还原反应,Fe由+2价变为+3价,S由+6价变为+4价,生成的SO2和SO3的比例为1:1。
A.标准状况下的SO3为固态,当生成标准状况下气体22.4 L时,即SO2为1 mol,S由+6价变为+4价,转移2 mol电子,A错误;
B.6.4g SO2为0.1 mol,其中所含的质子数为(16+8×2)×0.1=3.2 mol;6.4g SO3为0.08 mol,其中所含的质子数为(16+8×3)×0.08=3.2 mol,前后两者相等,B正确;
C.SO2中S是sp2杂化,有一个电子对是孤对电子,所以分子构型是V型,SO3也是sp2杂化,但三个电子对全成键,其空间构型是平面三角形,SO2、SO3的中心原子杂化类型相同,空间构型不同,C错误;
D.吸收塔中SO3若用水吸收,发生反应:SO3+H2O![]() H2SO4,该反应为放热反应,放出的热量易导致酸雾形成,阻隔在三氧化硫和水之间,阻碍三氧化硫的被吸收;而浓硫酸的沸点高,难以气化,不会形成酸雾,同时三氧化硫易溶于浓硫酸,所以工业上从吸收塔顶部喷洒浓硫酸作吸收液,得到“发烟”硫酸,D正确;
H2SO4,该反应为放热反应,放出的热量易导致酸雾形成,阻隔在三氧化硫和水之间,阻碍三氧化硫的被吸收;而浓硫酸的沸点高,难以气化,不会形成酸雾,同时三氧化硫易溶于浓硫酸,所以工业上从吸收塔顶部喷洒浓硫酸作吸收液,得到“发烟”硫酸,D正确;
答案选BD。

【题目】甲醇既可用于基本有机原料,又可作为燃料用于替代矿物燃料。
(1)以下是工业上合成甲醇的反应:![]()
![]() 下表所列数据是该反应在不同温度下的化学平衡常数
下表所列数据是该反应在不同温度下的化学平衡常数![]() .
.
温度 | 250℃ | 300℃ | 350℃ |
K | 2.041 | 0.270 | 0.012 |
由表中数据判断反应I为 ______ 热反应(填“吸”或“放”) ![]() 某温度下,将2molCO和6molH2充入2L的密闭容器中,充分反应,达到平衡后,测得
某温度下,将2molCO和6molH2充入2L的密闭容器中,充分反应,达到平衡后,测得![]() ,则CO的转化率为 ______ ,此时的温度为 ______ 从表中选择.
,则CO的转化率为 ______ ,此时的温度为 ______ 从表中选择.
(2)已知在常温常压下:
①![]()
②![]()
③![]()
则反应![]() ______
______ ![]() 用
用![]() 、
、![]() 、
、![]() 表示
表示
(3)处理废水时,最后![]() 以
以![]() 形式除去,当
形式除去,当![]() 时,
时,![]() 沉淀完全,此时溶液的
沉淀完全,此时溶液的![]() ______ (已知,
______ (已知,![]() ,
,![]() )
)