题目内容
【题目】如图所示是部分短周期元素原子半径与原子序数的关系,则下列说法正确的是( )
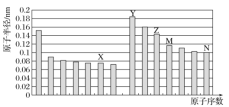
A.Z、N两种元素形成的化合物是离子化合物
B.通过M、N含氧酸的酸性强弱,可以比较两者的非金属性
C.Z的氧化物能分别溶解于Y的氢氧化物和N的氢化物的水溶液中
D.由X与M两种元素组成的化合物能与水反应
【答案】C
【解析】
同周期主族元素自左而右原子半径减小,同主族自上而下原子半径增大,故前7种元素处于第二周期,后7种元素处于第三周期,结合原子序数可知,X为O元素,Y为Na元素,Z为Al元素,M为Si元素,N为Cl元素,以此解答该题。
A.Z、N两种元素形成的化合物为氯化铝,为共价化合物,故A错误;
B.比较非金属性强弱关系时需要比较最高价含氧酸的酸性,含氧酸的描述不准确,故B错误;
C.Z的氧化物为氧化铝,是两性氧化物,能与Y的氢氧化物氢氧化钠反应生成偏铝酸钠,能与N的氢化物水溶液盐酸反应生成氯化铝,故C正确;
D.由X与M两种元素组成的化合物SiO2不与水反应,故D错误;
故答案为C。

 夺冠训练单元期末冲刺100分系列答案
夺冠训练单元期末冲刺100分系列答案 新思维小冠军100分作业本系列答案
新思维小冠军100分作业本系列答案 名师指导一卷通系列答案
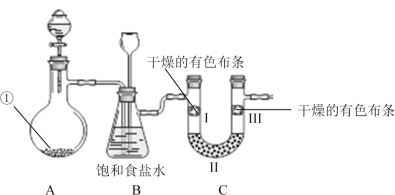
名师指导一卷通系列答案【题目】二氧化氯(ClO2)是一种新型消毒剂,可用氯酸钠(NaClO3)为原料制备。
(1)隔膜电解法制备ClO2的装置示意图如下:

已知:ClO2在酸性溶液中比较稳定,在碱性溶液中不能稳定存在。
①产生O2的电极反应式:________。
②结合反应方程式,简述ClO2的产生过程:_________。
(2)过氧化氢还原法制备ClO2:![]() 研究发现Cl-对上述反应有影响,实验记录如下:
研究发现Cl-对上述反应有影响,实验记录如下:
加入NaCl 的浓度/(g·L1) | ClO2的生成速率/(g·L-1·min-1) | 相同时间 | |||
10 min | 30 min | 60 min | ClO2 产率/% | Cl2 的量 | |
0 | 0.0035 | 0.0124 | 0.0159 | 97.12 | 极微量 |
1.00 | 0.0138 | 0.0162 | 0.0163 | 98.79 | 极微量 |
①NaCl的主要作用是_______。
②上述反应可能的过程如下:
反应i:![]() +
+ ![]() + +
+ +
反应ii: Cl2 + H2O2 = 2Cl- + O2↑ + 2H+
将反应i填写完整_________。
③进一步研究发现,未添加Cl-时,体系中首先会发生反应生成Cl-,反应为:ClO3- + 3H2O2 = Cl- + 3O2↑+3H2O(反应iii)。分析反应i、ii、iii的速率大小关系并简要说明理由:_________。
(3)国家规定,饮用水中ClO2的残留量不得高于0.8 mg·L-1,检测步骤如下:
Ⅰ.取1.0L的酸性水样,加入过量的碘化钾,再用氢氧化钠溶液调至中性,使ClO2转化为![]() 。加入淀粉溶液,溶液变蓝。
。加入淀粉溶液,溶液变蓝。
Ⅱ.用0.0010 mol/LNa2S2O3溶液滴定步骤I中产生的I2。已知:步骤II中发生反应的离子方程式是![]()
①步骤I中发生的氧化还原反应的离子方程式是________。
②当步骤II中出现________(填现象)时,停止滴加Na2S2O3溶液,记录其体积为10.00 mL。
③上述水样中ClO2的残留浓度是______mg·L-1。
【题目】“飘尘”是物质燃烧时产生的粒子漂浮物,颗粒很小(直径小于10-7m),不易沉降(可漂浮数小时甚至数年),它与空气中SO2、O2接触时,SO2部分转化为SO3,使空气中酸度增加形成酸雨。
(1)下列关于SO2的叙述中,正确的是_____;
A.SO2既可以做氧化剂,也可以做还原剂 B.SO2不是大汽污染物 C.大气中SO2的主要来源是汽车排出的尾气 D.SO2具有漂白性,因而可以使石蕊溶液褪色
(2)下列反应中,SO2表现了还原性的是_______;
A.SO2+H2OH2SO3 B.SO2+2NaOH=Na2CO3+H2O C.2SO2+O2![]() 2SO3 D.SO2+CaO=CaSO3
2SO3 D.SO2+CaO=CaSO3
(3)不能鉴别二氧化碳和二氧化硫的试剂是________;
A.品红溶液 B.澄清石灰水 C.溴水 D.酸性高锰酸钾溶液
(4)下列哪种危害不是酸雨导致的_______;
A.造成洪涝灾害 B.腐蚀建筑物 C.恶化人类环境 D.导致树木枯萎
(5)根据SO2通入不同溶液中实验现象,所得结论不正确的是_______;
溶液 | 现象 | 结论 | |
A | 含HCl、BaCl2的FeCl3溶液 | 产生白色沉淀 | SO2有还原性 |
B | H2S溶液 | 产生黄色沉淀 | SO2有氧化性 |
C | 酸性KMnO4溶液 | 紫色溶液褪色 | SO2有漂白性 |
D | Na2SiO3溶液 | 产生胶状沉淀 | 酸性:H2SO3>H2SiO3 |
(6)减少酸雨产生的途径可采取下列的哪些措施___________。
①少用煤做燃料 ②把工厂烟囱造高 ③燃料脱硫 ④飞机、汽车等交通工具采用清洁燃料,如天然气等 ⑤开发新能源