��Ŀ����
����Ŀ���������ȣ�ClO2����һ�����������������������ƣ�NaClO3��Ϊԭ���Ʊ���
��1����Ĥ��ⷨ�Ʊ�ClO2��װ��ʾ��ͼ���£�
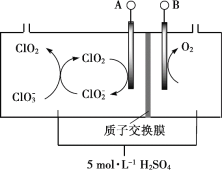
��֪��ClO2��������Һ�бȽ��ȶ����ڼ�����Һ�в����ȶ����ڡ�
�ٲ���O2�ĵ缫��Ӧʽ��________��
�ڽ�Ϸ�Ӧ����ʽ������ClO2�IJ������̣�_________��
��2���������ԭ���Ʊ�ClO2��![]() �о�����Cl-��������Ӧ��Ӱ�죬ʵ���¼���£�
�о�����Cl-��������Ӧ��Ӱ�죬ʵ���¼���£�
����NaCl ��Ũ��/(g��L1) | ClO2����������/(g��L-1��min-1) | ��ͬʱ�� | |||
10 min | 30 min | 60 min | ClO2 ����/% | Cl2 ���� | |
0 | 0.0035 | 0.0124 | 0.0159 | 97.12 | ���� |
1.00 | 0.0138 | 0.0162 | 0.0163 | 98.79 | ���� |
��NaCl����Ҫ������_______��
��������Ӧ���ܵĹ������£�
��Ӧi��![]() +
+ ![]() + +
+ +
��Ӧii�� Cl2 + H2O2 = 2Cl- + O2�� + 2H+
����Ӧi��д����_________��
�۽�һ���о����֣�δ����Cl-ʱ����ϵ�����Ȼᷢ����Ӧ����Cl-����ӦΪ��ClO3- + 3H2O2 = Cl- + 3O2��+3H2O����Ӧiii����������Ӧi��ii��iii�����ʴ�С��ϵ����Ҫ˵�����ɣ�_________��
��3�����ҹ涨������ˮ��ClO2�IJ��������ø���0.8 mg��L-1����ⲽ�����£�
����ȡ1.0L������ˮ������������ĵ⻯�أ���������������Һ�������ԣ�ʹClO2ת��Ϊ![]() �����������Һ����Һ������
�����������Һ����Һ������
������0.0010 mol/LNa2S2O3��Һ�ζ�����I�в�����I2����֪������II�з�����Ӧ�����ӷ���ʽ��![]()
�ٲ���I�з�����������ԭ��Ӧ�����ӷ���ʽ��________��
�ڵ�����II�г���________��������ʱ��ֹͣ�μ�Na2S2O3��Һ����¼�����Ϊ10.00 mL��
������ˮ����ClO2�IJ���Ũ����______mg��L-1��
���𰸡�![]() ������Ӧ��
������Ӧ��![]() ��������
��������![]() ����Һ����
����Һ����![]() ������Ӧ��
������Ӧ��
![]() ��
��![]() һ�����ݳ���һ����ѭ����Ӧ ����
һ�����ݳ���һ����ѭ����Ӧ ���� ![]() ��Ӧi�Ͽ죬��Ӧii �뷴Ӧi �����൱����죬��Ӧiii ��������ΪClO2���ʺܸ߲���Cl2�������������Ҳ�����Cl- ʱ��ʼ����ClO2�����ʺ���
��Ӧi�Ͽ죬��Ӧii �뷴Ӧi �����൱����죬��Ӧiii ��������ΪClO2���ʺܸ߲���Cl2�������������Ҳ�����Cl- ʱ��ʼ����ClO2�����ʺ��� ![]() ��Һ��ɫǡ����ʧ��30 s �ڲ���Ϊ��ɫ 0.675
��Һ��ɫǡ����ʧ��30 s �ڲ���Ϊ��ɫ 0.675
��������
(1)����Ԫ�ػ��ϼ����߲���O2���������������ɣ�
�ڸ���װ��ͼ��![]() �������õ�������
�������õ�������![]() ��
��![]() ����Һ��ClO3-��Ӧ����
����Һ��ClO3-��Ӧ����![]() ��
��
��2���ٸ��ݱ������ݣ���֪����NaCl������![]() ��������������
��������������
���ܷ�Ӧ����Ӧii�ɵ÷�Ӧi��
�۸���ClO2���ʺܸ߲���Cl2�������������Ҳ�����Cl- ʱ��ʼ����ClO2�����ʺ���������Ӧi��ii��iii�����ʴ�С��
��3���ٲ���I��ClO2������ӷ�Ӧ����![]() �͵ⵥ�ʣ�
�͵ⵥ�ʣ�
�ڵ��ⵥ����ȫ��Ӧʱ����Һ��ɫ��ʧ��
�۸���![]() ��
��![]() ����֪ClO2��
����֪ClO2��![]() �Ĺ�ϵʽ�����ݹ�ϵʽ����ClO2����Ũ�ȡ�
�Ĺ�ϵʽ�����ݹ�ϵʽ����ClO2����Ũ�ȡ�
(1)��ˮ����Ԫ�ػ��ϼ����߲���O2���������������ɣ�������Ӧʽ��![]() ��
��
�ڸ���װ��ͼ��ClO2�IJ��������ǣ�����������Ӧ![]() ��������
��������![]() ����Һ����
����Һ����![]() ������Ӧ��
������Ӧ��![]() ��
��![]() һ�����ݳ���һ����ѭ����Ӧ��
һ�����ݳ���һ����ѭ����Ӧ��
��2�����ݱ������ݣ���֪����NaCl������![]() ������������������NaCl����Ҫ����������Ӧ�Ĵ�����
������������������NaCl����Ҫ����������Ӧ�Ĵ�����
���ܷ�Ӧ�����ӷ���ʽ��![]() ���ܷ�Ӧ����Ӧii�ɵ�
���ܷ�Ӧ����Ӧii�ɵ�
![]() ��
��
�۸���ClO2���ʺܸ߲���Cl2�������������Ҳ�����Cl- ʱ��ʼ����ClO2�����ʺ��������Է�Ӧi�Ͽ죬��Ӧii �뷴Ӧi �����൱����죬��Ӧiii ������
��3���ٲ���I��ClO2������ӷ�Ӧ����![]() �͵ⵥ�ʣ���Ӧ�����ӷ���ʽ��
�͵ⵥ�ʣ���Ӧ�����ӷ���ʽ��![]() ��
��
�ڵ��ⵥ����ȫ��Ӧʱ����Һ��ɫ��ʧ��������II����ɫǡ����ʧ��30 s �ڲ���Ϊ��ɫʱ���ﵽ�ζ��յ㣬ֹͣ�μ�Na2S2O3��Һ��
�۸���![]() ��
��![]() ����֪ClO2��
����֪ClO2��![]() �����ʵ�������1:1��
�����ʵ�������1:1��
��ˮ����ClO2�����ʵ�����nmol��
ClO2�D�D�D�D�D![]()
1 1
nmol 0.0010 mol/L��0.01L
���n=1��10 -5mol��
ClO2�IJ���Ũ����1��10 -5mol��67.5g/mol��103��1L=0.675 mg��L-1��

����Ŀ������ʵ�ˮ��Һ�д��ڵ���ƽ�⡣
��1�������dz��������ᡣ
�ٴ�����ˮ��Һ�еĵ��뷽��ʽΪ____________��
�����з����У�����ʹ������Һ��CH3COOH����̶��������_______������ĸ��ţ���
a �μ�����Ũ���� b ����Һ
c ��ˮϡ�� d �������������ƾ���
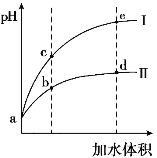
��2����0.1 mol��L-1 NaOH��Һ�ֱ�ζ������Ϊ20mL��Ũ�Ⱦ�Ϊ0.1 mol��L-1������ʹ�����Һ���õ��ζ���������ҺpH�����NaOH��Һ������仯�������ζ����ߡ�

�ٵζ������������___________������I��������������
�ڵζ���ʼǰ��0.1 mol��L-1 NaOH��0.1 mol��L-1�������0.1 mol��L-1����������Һ����ˮ�������c(H+)������_______��Һ��
��ͼI�У�V=10ʱ����Һ�е�c(H+)_________c(OH-) ������>��������������<������ͬ����c(Na+)_________c(CH3COO-)��
��3���±�Ϊijͬѧ����25��ʱ���ס���������Һ��pH��
�� | �� | |
pH | 11 | 11 |
��Һ | ��ˮ | ����������Һ |
�ټ���Һ�е�c(OH-) =___________mol/L��
��25��ʱ��������ļס�������Һ���Ũ�ȵ����ᷴӦ�����ĵ������������_____�ҡ�
�ۼס�����Һ����ˮϡ��10����������Һ��pH����_____�ҡ�
��4��ú̿��ҵ�о������������SO2��Ϊ��ֹ��Ⱦ���������������շ����д������������ʿ���������SO2����____________��
A H2O2 B Na2CO3 C Na2SO3 D Ca(OH)2
��5���±��Ǽ��ֳ�������ĵ��볣��
��ѧʽ | CH3COOH | H2SO3 | HClO | H2CO3 |
���� ���� | 1.8��10-5 | K1=1.23��10-2 K2=6.6��10-8 | 3.0��10-8 | K1=4.4��10-7 K2=4.7��10-11 |
/span>
���·�Ӧ��Ӧ�����ӷ���ʽ��ȷ����___________��
A Na2CO3��Һ��������SO2��CO32-+SO2+H2O = SO32-+HCO3-
B Ư��Һ��Ч��ԭ����ClO-+CO2+H2O = HClO+HCO3-
C ����������Һ��������SO2��ClO-+SO2+H2O = HClO+SO32-
D �����ˮ���е�CaCO3��2CH3COOH+CaCO3 = Ca2++2CH3COO-+H2O+CO2��