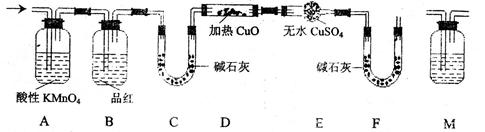
题目内容
向50 mL 18 mol·L-1的H2SO4溶液中加入适量的铜片并加热。充分反应后,被还原的H2SO4的物质的量
| A.小于0.45 mol | B.等于0.45 mol |
| C.在0.45~0.90 mol之间 | D.大于0.45 mol |
A
18 mol·L-1的H2SO4为浓硫酸,n(H2SO4)=" 18" mol·L-1×0.05L="0.9" mol,H2SO4被还原后生成SO2,若硫酸完全反应,则:
Cu+2H2SO4(浓)=△= CuSO4+ SO2↑+ H2O
2 1
0.9 mol n(SO2)
则n(SO2)="0.45" mol
但随着反应的进行,浓硫酸将变为稀硫酸,而稀硫酸不与铜反应,故实际生成n(SO2)<0.45 mol,故A正确
Cu+2H2SO4(浓)=△= CuSO4+ SO2↑+ H2O
2 1
0.9 mol n(SO2)
则n(SO2)="0.45" mol
但随着反应的进行,浓硫酸将变为稀硫酸,而稀硫酸不与铜反应,故实际生成n(SO2)<0.45 mol,故A正确

练习册系列答案
相关题目
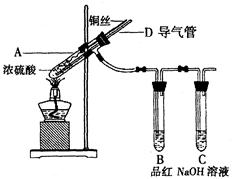
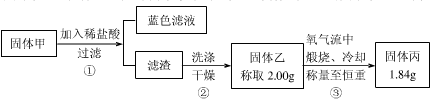
 SO2外,还可能含有H2和Q气体。为此设计了下
SO2外,还可能含有H2和Q气体。为此设计了下