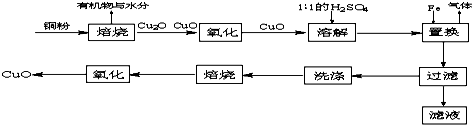
题目内容
15.下列离子方程式不正确的是( )| A. | NaNO2溶液中加入酸性KMnO4溶液:2MnO4-+5NO2-+6H+=2Mn2++5NO3-+3H2O | |
| B. | 0.5mol/L的NaHSO3溶液与1.0mol/L的NaClO溶液等体积混合:HSO3-+2ClO-=SO42-+Cl-+HClO | |
| C. | Fe(NO3)3溶液中加入过量的HI溶液:2Fe3++2I-═2Fe2++I2 | |
| D. | NH4HSO4的稀溶液中逐滴加入Ba(OH)2溶液至SO42-恰好沉淀完全:NH4++H++SO42-+Ba2++2OH-=NH3?H2O+BaSO4↓+H2O |
分析 A、离子方程式中电荷守恒、原子守恒、氧化还原反应电子守恒分析判断;
B、0.5mol/L的NaHSO3溶液与1.0mol/L的NaClO溶液等体积混合生成硫酸钠、氯化钠和次氯酸;
C、硝酸铁具有氧化性能氧化碘化氢为碘单质;
D、NH4HSO4的稀溶液中逐滴加入Ba(OH)2溶液至SO42-恰好沉淀完全,二者按照物质的量1:1反应,氢氧根离子和铵根离子、氢离子恰好反应;
解答 解:A、离子方程式中电荷守恒、原子守恒、氧化还原反应电子守恒分析判断,NaNO2溶液中加入酸性KMnO4溶液反应的离子方程式:2MnO4-+5NO2-+6H+=2Mn2++5NO3-+3H2O,故A正确;
B、0.5mol/L的NaHSO3溶液与1.0mol/L的NaClO溶液等体积混合生成硫酸钠、氯化钠和次氯酸,反应的离子方程式为:HSO3-+2ClO-=SO42-+Cl-+HClO,故B正确;
C、硝酸铁具有氧化性能氧化碘化氢为碘单质,酸性溶液中硝酸根离子氧化过量的碘离子,反应的离子方程式Fe3++NO3-++4H++4I-═Fe2++NO+2H2O+2I2,故C错误;
D、NH4HSO4的稀溶液中逐滴加入Ba(OH)2溶液至SO42-恰好沉淀完全,二者按照物质的量1:1反应,氢氧根离子和铵根离子、氢离子恰好反应,反应的离子方程式为:NH4++H++SO42-+Ba2++2OH-=NH3?H2O+BaSO4↓+H2O,故D正确;
故选C.
点评 本题考查了离子方程式的书写方法和离子定量关系,注意离子性质和离子反应实质的理解应用,掌握基础是解题关键,题目难度中等.

练习册系列答案
相关题目
5.如图实验装置不能达到实验目的是( )
| A. |  比较非金属性强弱:S>C>Si 比较非金属性强弱:S>C>Si | B. | 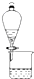 分离CH3COOC2H5和饱和碳酸钠溶液 分离CH3COOC2H5和饱和碳酸钠溶液 | ||
| C. |  观察纯碱的焰色反应 观察纯碱的焰色反应 | D. | 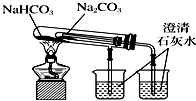 比较Na2CO3和NaHCO3的热稳定性 |
6.不经过净化处理的煤燃烧时容易释放出多种污染大气的有毒气体.下列气体中属于无毒气体的是( )
| A. | NO2 | B. | CO2 | C. | SO2 | D. | NO |
3.下列各组元素性质递变情况错误的是( )
①Li、B、Be原子最外层电子数依次增多
②P、S、Cl元素最高正化合价依次升高
③B、C、N、O、F原子半径依次增大
④Li、Na、K、Rb的原子半径依次增大.
①Li、B、Be原子最外层电子数依次增多
②P、S、Cl元素最高正化合价依次升高
③B、C、N、O、F原子半径依次增大
④Li、Na、K、Rb的原子半径依次增大.
| A. | ① | B. | ①③ | C. | ③ | D. | ②④ |
10.用NA表示阿伏加德罗常数的数值,则下列说法中正确的是( )
| A. | 标准状况下,11.2L以任意比例混合的氮气和氧气所含的原子数为NA | |
| B. | 常温常压下,16克氧气含原子数为2NA | |
| C. | 0.1 mol•L-1的 FeCl3溶液Cl-的数目为0.3NA | |
| D. | 由1L 1 mol•L-1的 FeCl3溶液制成的胶体中胶粒总数为NA个 |
7.按照物质的树状分类和交叉分类,HNO3应属于( )
①酸 ②氢化物 ③氧化物 ④含氧酸 ⑤难挥发性 ⑥强氧化性 ⑦一元酸 ⑧化合物 ⑨混合物.
①酸 ②氢化物 ③氧化物 ④含氧酸 ⑤难挥发性 ⑥强氧化性 ⑦一元酸 ⑧化合物 ⑨混合物.
| A. | ①②③④⑤⑥⑦⑧ | B. | ①④⑥⑦⑧ | C. | ①⑨ | D. | ①④⑤⑥⑦ |