题目内容
5.如图实验装置不能达到实验目的是( )| A. |  比较非金属性强弱:S>C>Si 比较非金属性强弱:S>C>Si | B. | 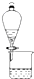 分离CH3COOC2H5和饱和碳酸钠溶液 分离CH3COOC2H5和饱和碳酸钠溶液 | ||
| C. |  观察纯碱的焰色反应 观察纯碱的焰色反应 | D. | 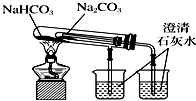 比较Na2CO3和NaHCO3的热稳定性 |
分析 A.元素的非金属性越强,其最高价氧化物的水化物酸性越强,强酸能和弱酸盐反应生成弱酸;
B.互不相溶的液体采用分液方法分离;
C.铂丝的焰色反应呈无色,钠元素焰色反应呈黄色;
D.小试管的温度较低,碳酸氢钠应放在套装小试管中.
解答 解:A.元素的非金属性越强,其最高价氧化物的水化物酸性越强,强酸能和弱酸盐反应生成弱酸,硫酸和碳酸钠反应生成二氧化碳、二氧化碳和硅酸钠反应生成难溶性硅酸,所以硅酸钠溶液中产生沉淀,该实验能证明非金属性S>C>Si,故A正确;
B.乙酸乙酯和碳酸钠溶液不互溶,可以采用分液方法分离,故B正确;
C.铁丝的焰色反应为无色,可用来做纯碱的焰色反应,能够达到实验目的,故C正确;
D.套装小试管加热温度较低,碳酸氢钠应放在套装小试管中,通过澄清水是否变浑浊可证明稳定性,题中装置无法达到实验目的,故D错误;
故选D.
点评 本题考查化学实验方案评价,涉及焰色反应、非金属性强弱判断、物质分离和提纯、物质稳定性强弱判断等知识点,侧重于学生的分析能力和实验能力的考查,为高考常见题型,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
15.下表列出了一些反应在使用催化剂前后的活化能的数据以及化学反应速率常数之比.
请根据表中数据分析:催化剂能加快化学反应速率(“加快”或“减小’),催化剂是通过参与反应改变反应历程,不能来提高化学反应的平衡常数,不能改变平衡转换率.
| 化学反应 | 催化剂 | Ea/KJ•mol-1 | k(催)/k(无) | |
| 无催化剂 | 有催化剂 | |||
| C12H22O11(蔗糖)+H2O═ C6H12O6 (葡萄糖)+C6H12O6(果糖) | 蔗糖酶 | 107 | 36 | 9.2×1011(310K) |
| 2HI═H2+I2 | 金 | 184 | 105 | 1.6×108(503K) |
| CH3CHO═CH4+CO | 碘 | 210 | 136 | 7.5×104(793K) |
| 2H2O2═2H2O+O2 | 过氧化氢酶 | 75 | 25 | 5.8×108(298K) |
13.(1)镍氢碱性充电电池被誉为“绿色化学电源”,充、放电时的反应:2Ni(OH)2 $?_{放电}^{充电}$2NiO(OH)+H2.放电时,正极的电极反应式为NiOOH+e-+H2O=Ni(OH)2+OH-,充电时,该电极应与电源的正(填“正”或“负”)极相连.
(2)氨在空气中燃烧,生成水和氮气.已知:N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ•mol-1,2H2(g)+O2(g)═2H2O(l)△H=-572kJ•mol-1.则氨在空气中燃烧生成液态水和氮气时的热化学方程式为:4NH3(g)+3O2(g)=2N2(g)+6H2O(l);△H=-1531.2kJ•mol-1.
(3)研究表明工业上合成氨反应(N2(g)+3H2(g)?2NH3(g))在容积固定的密闭容器中发生上述反应,表中为各物质在不同时刻的浓度.
0~5min,H2的平均反应速率vH2=0.072mol/(L•min).反应在5分钟时,条件发生了改变,改变的条件可能是c(填序号).
a.增加氢气的浓度 b.降低温度 c.使用催化剂 d.分离出NH3.
(2)氨在空气中燃烧,生成水和氮气.已知:N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ•mol-1,2H2(g)+O2(g)═2H2O(l)△H=-572kJ•mol-1.则氨在空气中燃烧生成液态水和氮气时的热化学方程式为:4NH3(g)+3O2(g)=2N2(g)+6H2O(l);△H=-1531.2kJ•mol-1.
(3)研究表明工业上合成氨反应(N2(g)+3H2(g)?2NH3(g))在容积固定的密闭容器中发生上述反应,表中为各物质在不同时刻的浓度.
| 时间/min | C(N2)/mol.L-1 | C(H2)/mol.L-1 | C(NH3)/mol.L-1 |
| 0 | 0.6 | 1.8 | 0 |
| 5 | 0.48 | X | 0.24 |
| 10 | 0.26 | 0.78 | 0.68 |
a.增加氢气的浓度 b.降低温度 c.使用催化剂 d.分离出NH3.
20.铝热反应是铝的一个重要性质,该性质用途十分广泛,不仅被用于焊接钢轨,而且还常被用于冶炼高熔点的金属如钒、铬、锰等.
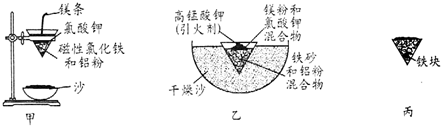
(1)某校化学兴趣小组同学,取磁性氧化铁按教材中的实验装置(如图甲)进行铝热反应,现象很壮观.取反应后的“铁块”溶于盐酸,向其中滴加KSCN溶液,发现溶液变血红色.出现这种现象的原因,除了可能混有没反应完的磁性氧化铁外,还有一个原因是熔融的铁被空气中氧气氧化.
(2)若证明上述所得“铁块”中含有金属铝,可选择氢氧化钠溶液(填试剂名称)进行实验,所发生反应的离子方程式为:2Al+2OH-+2H2O=2AlO2-+3H2↑.
(3)为克服图甲的缺陷改用图乙装置进行铝热反应.取反应后的“铁块”溶于盐酸,向其中滴加KSCN溶液,溶液没有出现血红色.为测定该实验所得“铁块”的成分,实验流程如图所示.

几种氢氧化物开始沉淀和完全沉淀的pH如下表所示.
①试剂A应选择C,试剂B应选择D.(填序号)
A.稀盐酸 B.氧化铁 C.H2O2溶液 D.氨水 E.MgCO3固体
②已知常温下Fe(OH)3的Ksp=1.1×10-36,则反应Ⅲ后溶液中c(Fe3+)=1.1×10-6mol•L-1.
③灼烧完全的标志是前后两次灼烧质量相差不大于0.1g.
④若最终红色粉未M的质量为12.0g,则该“铁块”的纯度是84%.如果对所得过滤固体直接洗涤、烘干、称量,计算“铁块”的纯度,则计算结果会偏小(填“偏大”“偏小”或“无影响”)原因是Fe(OH)3在烘干过程中会有部分发生分解反应,质量变小.

(1)某校化学兴趣小组同学,取磁性氧化铁按教材中的实验装置(如图甲)进行铝热反应,现象很壮观.取反应后的“铁块”溶于盐酸,向其中滴加KSCN溶液,发现溶液变血红色.出现这种现象的原因,除了可能混有没反应完的磁性氧化铁外,还有一个原因是熔融的铁被空气中氧气氧化.
(2)若证明上述所得“铁块”中含有金属铝,可选择氢氧化钠溶液(填试剂名称)进行实验,所发生反应的离子方程式为:2Al+2OH-+2H2O=2AlO2-+3H2↑.
(3)为克服图甲的缺陷改用图乙装置进行铝热反应.取反应后的“铁块”溶于盐酸,向其中滴加KSCN溶液,溶液没有出现血红色.为测定该实验所得“铁块”的成分,实验流程如图所示.

几种氢氧化物开始沉淀和完全沉淀的pH如下表所示.
| Fe2+ | Fe3+ | Al3+ | Mg2+ | |
| 开始沉淀时的pH | 7.5 | 2.8 | 4.2 | 9.6 |
| 沉淀完全时的pH | 9.0 | 4.0 | 5 | 11 |
A.稀盐酸 B.氧化铁 C.H2O2溶液 D.氨水 E.MgCO3固体
②已知常温下Fe(OH)3的Ksp=1.1×10-36,则反应Ⅲ后溶液中c(Fe3+)=1.1×10-6mol•L-1.
③灼烧完全的标志是前后两次灼烧质量相差不大于0.1g.
④若最终红色粉未M的质量为12.0g,则该“铁块”的纯度是84%.如果对所得过滤固体直接洗涤、烘干、称量,计算“铁块”的纯度,则计算结果会偏小(填“偏大”“偏小”或“无影响”)原因是Fe(OH)3在烘干过程中会有部分发生分解反应,质量变小.
10.下列实验操作中正确的是( )
| A. | 应使混合物中的水分完全蒸干后,才能停止加热 | |
| B. | 分液操作时,下层液体从分液漏斗下口放出后再将上层液体从下口放出到另一个烧杯中 | |
| C. | 萃取操作时,应选择有机萃取剂,且萃取剂的密度必须比水大 | |
| D. | 蒸馏操作时,应使温度计水银球靠近蒸馏烧瓶的支管口处 |
17.下列离子方程式正确的是( )
| A. | 稀硫酸滴在铜片上 Cu+2H+=Cu2++H2↑ | |
| B. | 氢氧化镁与盐酸的反应 H++OH-=H2O | |
| C. | 澄清石灰水与盐酸的反应 Ca(OH)2+2H+=Ca2++2H2O | |
| D. | 碳酸钙溶于稀盐酸中 CaCO3+2H+=Ca2++H2O+CO2↑ |
14.实验室由海水获得淡水的实验装置是( )
| A. |  | B. |  | ||
| C. | 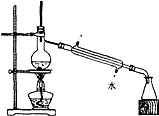 | D. |  |
15.下列离子方程式不正确的是( )
| A. | NaNO2溶液中加入酸性KMnO4溶液:2MnO4-+5NO2-+6H+=2Mn2++5NO3-+3H2O | |
| B. | 0.5mol/L的NaHSO3溶液与1.0mol/L的NaClO溶液等体积混合:HSO3-+2ClO-=SO42-+Cl-+HClO | |
| C. | Fe(NO3)3溶液中加入过量的HI溶液:2Fe3++2I-═2Fe2++I2 | |
| D. | NH4HSO4的稀溶液中逐滴加入Ba(OH)2溶液至SO42-恰好沉淀完全:NH4++H++SO42-+Ba2++2OH-=NH3?H2O+BaSO4↓+H2O |