题目内容
10.用NA表示阿伏加德罗常数的数值,则下列说法中正确的是( )| A. | 标准状况下,11.2L以任意比例混合的氮气和氧气所含的原子数为NA | |
| B. | 常温常压下,16克氧气含原子数为2NA | |
| C. | 0.1 mol•L-1的 FeCl3溶液Cl-的数目为0.3NA | |
| D. | 由1L 1 mol•L-1的 FeCl3溶液制成的胶体中胶粒总数为NA个 |
分析 A、标况下,11.2L任何气体的物质的量均为0.5mol,而氮气和氧气均为双原子分子;
B、氧气由氧原子构成;
C、溶液体积不明确;
D、一个氢氧化铁胶粒是多个氢氧化铁的聚集体.
解答 解:A、标况下,11.2L任何气体的物质的量均为0.5mol,而氮气和氧气均为双原子分子,故0.5mol氮气和氧气的混合气体中含1mol原子即NA个,故A正确;
B、氧气由氧原子构成,故16g氧气中含有的氧原子的物质的量n=$\frac{16g}{16g/mol}$=1mol,即NA个,故B错误;
C、溶液体积不明确,故溶液中的氯离子的个数无法计算,故C错误;
D、一个氢氧化铁胶粒是多个氢氧化铁的聚集体,故1mol氯化铁制成的胶粒的个数小于NA个,故D错误.
故选A.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
 中考解读考点精练系列答案
中考解读考点精练系列答案
相关题目
20.铝热反应是铝的一个重要性质,该性质用途十分广泛,不仅被用于焊接钢轨,而且还常被用于冶炼高熔点的金属如钒、铬、锰等.
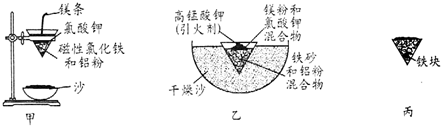
(1)某校化学兴趣小组同学,取磁性氧化铁按教材中的实验装置(如图甲)进行铝热反应,现象很壮观.取反应后的“铁块”溶于盐酸,向其中滴加KSCN溶液,发现溶液变血红色.出现这种现象的原因,除了可能混有没反应完的磁性氧化铁外,还有一个原因是熔融的铁被空气中氧气氧化.
(2)若证明上述所得“铁块”中含有金属铝,可选择氢氧化钠溶液(填试剂名称)进行实验,所发生反应的离子方程式为:2Al+2OH-+2H2O=2AlO2-+3H2↑.
(3)为克服图甲的缺陷改用图乙装置进行铝热反应.取反应后的“铁块”溶于盐酸,向其中滴加KSCN溶液,溶液没有出现血红色.为测定该实验所得“铁块”的成分,实验流程如图所示.

几种氢氧化物开始沉淀和完全沉淀的pH如下表所示.
①试剂A应选择C,试剂B应选择D.(填序号)
A.稀盐酸 B.氧化铁 C.H2O2溶液 D.氨水 E.MgCO3固体
②已知常温下Fe(OH)3的Ksp=1.1×10-36,则反应Ⅲ后溶液中c(Fe3+)=1.1×10-6mol•L-1.
③灼烧完全的标志是前后两次灼烧质量相差不大于0.1g.
④若最终红色粉未M的质量为12.0g,则该“铁块”的纯度是84%.如果对所得过滤固体直接洗涤、烘干、称量,计算“铁块”的纯度,则计算结果会偏小(填“偏大”“偏小”或“无影响”)原因是Fe(OH)3在烘干过程中会有部分发生分解反应,质量变小.

(1)某校化学兴趣小组同学,取磁性氧化铁按教材中的实验装置(如图甲)进行铝热反应,现象很壮观.取反应后的“铁块”溶于盐酸,向其中滴加KSCN溶液,发现溶液变血红色.出现这种现象的原因,除了可能混有没反应完的磁性氧化铁外,还有一个原因是熔融的铁被空气中氧气氧化.
(2)若证明上述所得“铁块”中含有金属铝,可选择氢氧化钠溶液(填试剂名称)进行实验,所发生反应的离子方程式为:2Al+2OH-+2H2O=2AlO2-+3H2↑.
(3)为克服图甲的缺陷改用图乙装置进行铝热反应.取反应后的“铁块”溶于盐酸,向其中滴加KSCN溶液,溶液没有出现血红色.为测定该实验所得“铁块”的成分,实验流程如图所示.

几种氢氧化物开始沉淀和完全沉淀的pH如下表所示.
| Fe2+ | Fe3+ | Al3+ | Mg2+ | |
| 开始沉淀时的pH | 7.5 | 2.8 | 4.2 | 9.6 |
| 沉淀完全时的pH | 9.0 | 4.0 | 5 | 11 |
A.稀盐酸 B.氧化铁 C.H2O2溶液 D.氨水 E.MgCO3固体
②已知常温下Fe(OH)3的Ksp=1.1×10-36,则反应Ⅲ后溶液中c(Fe3+)=1.1×10-6mol•L-1.
③灼烧完全的标志是前后两次灼烧质量相差不大于0.1g.
④若最终红色粉未M的质量为12.0g,则该“铁块”的纯度是84%.如果对所得过滤固体直接洗涤、烘干、称量,计算“铁块”的纯度,则计算结果会偏小(填“偏大”“偏小”或“无影响”)原因是Fe(OH)3在烘干过程中会有部分发生分解反应,质量变小.
1.下列关于乙烯的说法正确的是( )
| A. | 是天然气的主要成分 | B. | 能使溴的四氯化碳溶液褪色 | ||
| C. | 不能发生燃烧反应 | D. | 不能发生加聚反应 |
18.下列反应的离子方程式书写正确的是( )
| A. | 铝粉投入氢氧化钠溶液中:2Al+2OH-═2AlO${\;}_{2}^{-}$+H2↑ | |
| B. | 硫酸与氢氧化钠溶液反应:H++OH-═H2O | |
| C. | 大理石与醋酸反应:CaCO3+2H+═Ca2++CO2↑+H2O | |
| D. | 硫酸铜溶液和氢氧化钡溶液反应:Ba2++SO${\;}_{4}^{2-}$═BaSO4↓ |
15.下列离子方程式不正确的是( )
| A. | NaNO2溶液中加入酸性KMnO4溶液:2MnO4-+5NO2-+6H+=2Mn2++5NO3-+3H2O | |
| B. | 0.5mol/L的NaHSO3溶液与1.0mol/L的NaClO溶液等体积混合:HSO3-+2ClO-=SO42-+Cl-+HClO | |
| C. | Fe(NO3)3溶液中加入过量的HI溶液:2Fe3++2I-═2Fe2++I2 | |
| D. | NH4HSO4的稀溶液中逐滴加入Ba(OH)2溶液至SO42-恰好沉淀完全:NH4++H++SO42-+Ba2++2OH-=NH3?H2O+BaSO4↓+H2O |
19.某无色溶液中,可大量共存的离子组是( )
| A. | Na+、HCO3-、SO42-、Br- | B. | Cu2+、NO3-、Cl-、SO42- | ||
| C. | H+、Cl-、Na+、CO32- | D. | H+、Na+、S2-、NO3- |