题目内容
3.下列各组元素性质递变情况错误的是( )①Li、B、Be原子最外层电子数依次增多
②P、S、Cl元素最高正化合价依次升高
③B、C、N、O、F原子半径依次增大
④Li、Na、K、Rb的原子半径依次增大.
| A. | ① | B. | ①③ | C. | ③ | D. | ②④ |
分析 ①同周期元素的原子,从左到右,最外层电子数依次增多;
②元素最高正价=最外层电子数;
③同周期元素的原子,从左到右,原子半径依次减小;
④同一主族元素,从上到下,原子半径依次增大.
解答 解:①Li、B、Be原子最外层电子数依次为1、2、2,故①错误;
②P、S、Cl元素最高正价依次为+5、+6、+7,逐渐升高,故②正确;
③N、O、F是同周期元素的原子,从左到右,原子半径依次减小,故③错误;
④Li、Na、K、Rb是同主族元素,从上到下的原子半径依次增大,故④正确.
故选B.
点评 本题考查元素周期律知识,为高考常见题型,侧重于学生的分析能力和双基的考查,注意把握元素周期律的递变规律以及金属性、非金属性质与对应单质、化合物的性质,注意难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
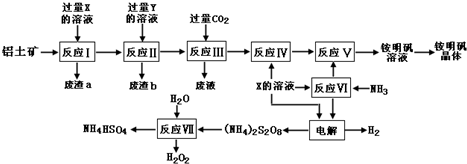
13.(1)镍氢碱性充电电池被誉为“绿色化学电源”,充、放电时的反应:2Ni(OH)2 $?_{放电}^{充电}$2NiO(OH)+H2.放电时,正极的电极反应式为NiOOH+e-+H2O=Ni(OH)2+OH-,充电时,该电极应与电源的正(填“正”或“负”)极相连.
(2)氨在空气中燃烧,生成水和氮气.已知:N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ•mol-1,2H2(g)+O2(g)═2H2O(l)△H=-572kJ•mol-1.则氨在空气中燃烧生成液态水和氮气时的热化学方程式为:4NH3(g)+3O2(g)=2N2(g)+6H2O(l);△H=-1531.2kJ•mol-1.
(3)研究表明工业上合成氨反应(N2(g)+3H2(g)?2NH3(g))在容积固定的密闭容器中发生上述反应,表中为各物质在不同时刻的浓度.
0~5min,H2的平均反应速率vH2=0.072mol/(L•min).反应在5分钟时,条件发生了改变,改变的条件可能是c(填序号).
a.增加氢气的浓度 b.降低温度 c.使用催化剂 d.分离出NH3.
(2)氨在空气中燃烧,生成水和氮气.已知:N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ•mol-1,2H2(g)+O2(g)═2H2O(l)△H=-572kJ•mol-1.则氨在空气中燃烧生成液态水和氮气时的热化学方程式为:4NH3(g)+3O2(g)=2N2(g)+6H2O(l);△H=-1531.2kJ•mol-1.
(3)研究表明工业上合成氨反应(N2(g)+3H2(g)?2NH3(g))在容积固定的密闭容器中发生上述反应,表中为各物质在不同时刻的浓度.
| 时间/min | C(N2)/mol.L-1 | C(H2)/mol.L-1 | C(NH3)/mol.L-1 |
| 0 | 0.6 | 1.8 | 0 |
| 5 | 0.48 | X | 0.24 |
| 10 | 0.26 | 0.78 | 0.68 |
a.增加氢气的浓度 b.降低温度 c.使用催化剂 d.分离出NH3.
14.实验室由海水获得淡水的实验装置是( )
| A. | 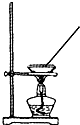 | B. |  | ||
| C. | 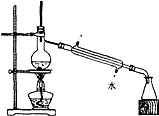 | D. |  |
11.下列物质属于同素异形体的是( )
| A. | 氕、氘、氚 | B. | 甲酸和乙酸 | ||
| C. | 金刚石与石墨 | D. | CH3CH2CH2CH3和CH(CH3)3 |
18.下列反应的离子方程式书写正确的是( )
| A. | 铝粉投入氢氧化钠溶液中:2Al+2OH-═2AlO${\;}_{2}^{-}$+H2↑ | |
| B. | 硫酸与氢氧化钠溶液反应:H++OH-═H2O | |
| C. | 大理石与醋酸反应:CaCO3+2H+═Ca2++CO2↑+H2O | |
| D. | 硫酸铜溶液和氢氧化钡溶液反应:Ba2++SO${\;}_{4}^{2-}$═BaSO4↓ |
15.下列离子方程式不正确的是( )
| A. | NaNO2溶液中加入酸性KMnO4溶液:2MnO4-+5NO2-+6H+=2Mn2++5NO3-+3H2O | |
| B. | 0.5mol/L的NaHSO3溶液与1.0mol/L的NaClO溶液等体积混合:HSO3-+2ClO-=SO42-+Cl-+HClO | |
| C. | Fe(NO3)3溶液中加入过量的HI溶液:2Fe3++2I-═2Fe2++I2 | |
| D. | NH4HSO4的稀溶液中逐滴加入Ba(OH)2溶液至SO42-恰好沉淀完全:NH4++H++SO42-+Ba2++2OH-=NH3?H2O+BaSO4↓+H2O |
12.下列说法正确的是(NA表示阿伏加德罗常数的值)( )
| A. | 11.2 L N2含有的分子数为0.5NA | |
| B. | 在常温常压下,1 mol Ne含有的原子数为NA | |
| C. | 71 g Cl2所含分子数为2NA | |
| D. | 在同温同压下,相同体积的任何气体单质所含的原子数相同 |
12.化学是以实验为基础的学科.利用已学知识对下列实验进行分析并填空:

Ⅰ.某研究性学习小组设计了一组实验来探究元素周期律.
甲同学根据元素非金属性与对应最高价含氧酸之间的关系,设计了如图1装置完成
同主族元素非金属性强弱比较的实验研究;
乙同学设计了如图2装置实验来验证卤族元素性质的递变规律(夹持装置已略去).A、B、C三个胶头滴管分别是氯酸钾溶液、NaBr溶液、淀粉KI溶液.已知常温下浓盐酸与氯酸钾溶液能反应生成氯气.
(1)甲同学设计实验所涉及的离子方程式为CaCO3+2H+=Ca2++CO2↑+H2O、SiO32-+CO2+H2O═H2SiO3↓+CO32-;
(2)乙同学具体操作如下:
①先挤压胶体滴管A,使少量溶液滴入烧瓶内;
②挤压体滴管B,使稍过量溶液滴入烧瓶内,充分反应.写出该操作中主要离子方程式为2Br-+Cl2?Br2+2Cl-.
③再挤压体滴管C,使少量溶液滴入烧瓶内,可观察到溶液由橙黄色变为蓝色;
(3)根据甲乙同学的实验可得到的结论是:同一主族元素,从上到下,元素的非金属性减弱.
Ⅱ.

Ⅰ.某研究性学习小组设计了一组实验来探究元素周期律.
甲同学根据元素非金属性与对应最高价含氧酸之间的关系,设计了如图1装置完成
同主族元素非金属性强弱比较的实验研究;
乙同学设计了如图2装置实验来验证卤族元素性质的递变规律(夹持装置已略去).A、B、C三个胶头滴管分别是氯酸钾溶液、NaBr溶液、淀粉KI溶液.已知常温下浓盐酸与氯酸钾溶液能反应生成氯气.
(1)甲同学设计实验所涉及的离子方程式为CaCO3+2H+=Ca2++CO2↑+H2O、SiO32-+CO2+H2O═H2SiO3↓+CO32-;
(2)乙同学具体操作如下:
①先挤压胶体滴管A,使少量溶液滴入烧瓶内;
②挤压体滴管B,使稍过量溶液滴入烧瓶内,充分反应.写出该操作中主要离子方程式为2Br-+Cl2?Br2+2Cl-.
③再挤压体滴管C,使少量溶液滴入烧瓶内,可观察到溶液由橙黄色变为蓝色;
(3)根据甲乙同学的实验可得到的结论是:同一主族元素,从上到下,元素的非金属性减弱.
Ⅱ.
| 实验目的 | 探究温度对双氧水分解反应的速率的影响 | ||
| 实验 | 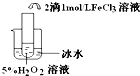 | 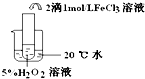 | 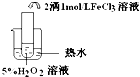 |
| 实验结论 | 结论:温度越高,反应速率越快 FeCl3在实验中的作用为:催化剂 | ||
| 反应方程式 | 2H2O2$\frac{\underline{\;FeCl_{3}\;}}{\;}$2H2O+O2↑ | ||