题目内容
【题目】NH3水溶液呈弱碱性,并可用作农业化肥,现进行下列研究:现将一定量的H2和N2充入10L的密闭容器中,在一定条件下使其发生反应,有关H2、N2、NH3三者的物质的量的变化与时间的关系如图所示:
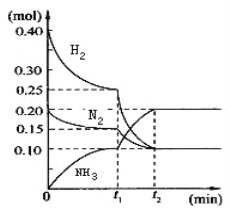
(1)若t1=10min,则0至t1时间内H2的反应速率为_________;
(2)下列几种情形中可以证明合成氨的反应N2(g)+3H2(g)![]() 2NH3(g)已达平衡状态的是_____。
2NH3(g)已达平衡状态的是_____。
①单位时间内生成nmolN2的同时生成2nmolNH3;
②1个N≡N键断裂的同时,有6个N—H键形成;
③1个N≡N键断裂的同时,有3个H—H键形成;
④混合气体的压强不再改变的状态;
⑤混合气体的密度不再改变的状态;
⑥混合气体的平均相对分子质量不再改变的状态。
(3)根据图中曲线变化情况判断,t1时刻改变的反应条件可能是_____(填字母)
a.加入了催化剂 b.降低了反应的温度 c.缩小容器体积增大压强
(4)t2时刻后反应达平衡,N2总共的转化率为______。
(5)在t1时刻对应的反应条件下,该反应的平衡常数是______。
【答案】0.0015mol/(L·min) ①③④⑥ c 50% 426.7
【解析】
根据图像可知,氢气、氮气的初始物质的量分别为0.40mol、0.20mol,反应在t1时达到平衡状态,平衡时,氢气、氮气、氨气的物质的量分别为0.25mol、0.15mol、0.10mol;t1时改变外界条件平衡正向移动。
N2(g)+3H2(g)![]() 2NH3(g)
2NH3(g)
初始: 0.20 0.40 0
反应1:0.05 0.15 0.10
平衡1:0.15 0.25 0.10
反应2:0.05 0.15 0.10
平衡2:0.10 0.10 0.20
(1)若t1=10min,0至t1时间内H2的量变化为0.15mol,v(H2)=0.15mol/(10L×10min)=0.0015mol/(L·min);
(2)①单位时间内生成nmolN2,则必然消耗2nmolNH3,若同时又生成2nmolNH3,正逆反应速率相等,反应达到平衡状态,①正确;
②1个N≡N键断裂,必然有6个N—H键形成,反应时按此比例进行,无法判断是否达到平衡状态,②错误;
③1个N≡N键断裂,必然有3个H—H也断裂,若同时有3个H—H键形成,则同一物质的反应方向相反,量相同,达到平衡状态,③正确;
④反应体系中,可逆号两边气体计量数不同,若达到平衡状态时,气体的物质的量不再改变,容器为恒容,则混合气体的压强不再改变的状态,压强可作为判断是否达到平衡状态的依据,④正确;
⑤反应体系中,反应物与生成物均为气体,则混合气体的质量自始至终不变,而容积固定,则密度一直不变,混合气体的密度不能作为判断是否平衡的依据,⑤错误;
⑥反应体系中,反应物与生成物均为气体,则混合气体的质量自始至终不变,若达到平衡时,气体的物质的量不再改变,则混合气体的平均相对分子质量不再改变,平均摩尔质量可作为判断是否达到平衡状态的依据,⑥正确;
答案为①③④⑥。
(3)a.催化剂对化学反应速率有影响,对限度无影响,a错误;
b.降低了反应的温度,化学反应速率减慢,曲线的变化斜率变小,与图像不符,b错误;
c.缩小容器体积增大压强,反应体系中的各物质浓度增大,反应速率加快,平衡正向移动,与图像相符,c正确;
答案为c;
(4)t2时刻后反应达平衡,氮气的反应量为0.1mol,初始量为0.2mol,转化率=0.1mol/0.2mol×100%=50%;
(5)t1时刻时达到平衡状态,K=c2(NH3)/[c3(H2)×c(N2)]=0.012/(0.0253×0.015)=426.7。

【题目】乙酸异戊酯是组成蜜蜂信息素的成分之一,具有香蕉的香味。实验室制备乙酸异戊酯的反应、装置示意图和有关数据如下:
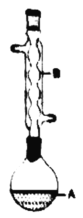

![]()
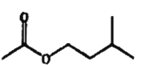 +H2O
+H2O
物质 | 相对分子质量 | 密度 | 沸点/℃ | 水中溶解性 |
异戊醇 | 88 | 0.8123 | 131 | 微溶 |
乙酸 | 60 | 1.0492 | 118 | 溶 |
乙酸异戊酯 | 130 | 0.8670 | 142 | 难溶 |
实验步骤:
在A中加入4.4g的异戊醇,6.0g的乙酸、数滴浓硫酸和2~3片碎瓷片,开始缓慢加热A,回流50min,反应液冷至室温后倒入分液漏斗中,分别用少量水,饱和碳酸氢钠溶液和水洗涤,分出的产物加入少量无水![]() 固体,静置片刻,过滤除去
固体,静置片刻,过滤除去![]() 固体,进行蒸馏纯化,收集140~143℃馏分,得乙酸异戊酯3.9g。回答下列问题:
固体,进行蒸馏纯化,收集140~143℃馏分,得乙酸异戊酯3.9g。回答下列问题:
(1)仪器A的名称是:________
(2)在洗涤操作中,第一次水洗的主要目的是:________;第二次水洗的主要目的是:________。
(3)在洗涤、分液操作中,应充分振荡,然后静置,待分层后________(填标号)。
a.直接将乙酸异戊酯从分液漏斗上口倒出
b.直接将乙酸异戊酯从分液漏斗下口放出
c..先将水层从分液漏斗的下口放出,再将乙酸异戊酯从下口放出
d.先将水层从分液漏斗的下口放出,再将乙酸异戊酯从上口放出
(4)本实验中加入过量乙酸的目的是:________________。
(5)实验中加入少量浓硫酸的目的是:________________。
(6)在蒸馏操作中加热一段时间发现忘加碎瓷片,应采取的正确操作是:________。(请用文字描述)
(7)本实验的产率是:________(
a.30% b.40% c.50% d.60%
(8)在进行蒸馏操作时,若从110℃便开始收集馏分,会使实验的产率偏________(填“高”或“低”),其原因是_______________________________________________。
【题目】100mL0.50mol/L盐酸与100mL0.55mol/LNaOH溶液在图示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:
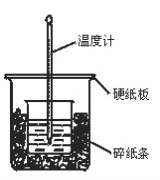
(1)从实验装置图看,尚缺少的一种玻璃仪器是________。
(2)烧杯间填充碎纸条的作用是_________。
(3)按如图装置进行实验,测得中和热的数值_______(填“偏大”“偏小”或“无影响”)其原因是_____。
(4)若实验中改用80 mL0.50mol/L盐酸跟80mL0.55mol/LNaOH溶液进行反应,与上述实验相比,所放出的热量_____(填“相等、“不相等”)。
(5)假设盐酸和氢氧化钠溶液的密度都是1g·cm-3,又知中和反应后生成溶液的比热容c=4.18J·g-1·℃-1。为了计算中和热,某学生实验记录数据如下:
实验序号 | 起始温度t1/℃ | 终止温度t2/℃ | |
盐酸 | 氢氧化钠溶液 | 混合溶液 | |
1 | 20.0 | 20.2 | 23.2 |
2 | 20.2 | 20.4 | 23.4 |
3 | 20.3 | 20.5 | 25.5 |
依据该学生测得的实验数据进行计算,中和热ΔH=______(结果保留一位小数)。
(6)能否用稀Ba(OH)2溶液和稀硫酸代替氢氧化钠溶液和盐酸反应测定中和热_______(填“能”或“否”)。