题目内容
【题目】毒重石的主要成分 BaCO3(含 Ca2+、Mg2+、Fe3+等杂质),实验室利用毒重石制备 BaCl2·2H2O 的流程如下:
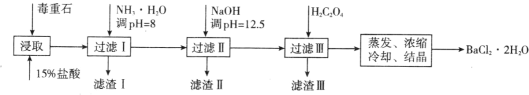
(1)毒重石用盐酸浸取前需充分研磨,目的是_______。实验室用 37%的盐酸配制 15%的盐酸,除量筒外还需使用下列仪器中的_______(填标号)。
a 烧杯 b 容量瓶 c 玻璃棒 d 滴定管
(2)
Ca2+ | Mg2 + | Fe3+ | |
开始沉淀时的 pH | 11.9 | 9.1 | 1.9 |
完全沉淀时的 pH | 13.9 | 11.1 | 3.2 |
流程中,滤渣Ⅱ中含_______(填化学式)。加入 H2C2O4 时应避免过量,原因是_______。 [已知:Ksp(BaC2O4)=1.6×10-7,Ksp(CaC2O4)=2.3×10-9]
(3)利用间接酸碱滴定法可测定 Ba2+的含量,实验分两步进行。已知:2CrO42-+2H+=Cr2O72-+H2O Ba2++CrO42-=BaCrO4↓
步骤Ⅰ:移取 xmL 一定浓度的 Na2CrO4 溶液与锥形瓶中,加入酸碱指示剂,用 b mol·L-1盐酸标准液滴定至终点,测得滴加盐酸体积为 V0 mL。
步骤Ⅱ:移取 y mLBaCl2 溶液于锥形瓶中,加入 x mL 与步骤Ⅰ相同浓度的 Na2CrO4 溶液,待 Ba2+完全沉淀后,再加入酸碱指示剂,用b mol·L-1盐酸标准液滴定至终点,测得滴加盐酸的体积为 V1 mL。滴加盐酸标准液时应用酸式滴定管,“0”刻度位于滴定管的_______(填“上方”或“下方”)。BaCl2 溶液的浓度为___________mol·L-1,若步骤Ⅱ中滴加盐酸时有少量待测液溅出,Ba2+浓度测量值将_______(填“偏大”或“偏小”或“无影响”)。
【答案】增大接触面积,使反应速率加快,提高浸取效率 ac Mg(OH)2、Ca(OH)2 H2C2O4过量会导致生成BaC2O4沉淀,产品的产量减少 上方 ![]() 偏大
偏大
【解析】
制备BaCl22H2O的流程:毒重石的主要成分BaCO3(含Ca2+、Mg2+、Fe3+等杂质),加盐酸溶解,碳酸钡和盐酸反应:BaCO3+2H+=Ba2++CO2↑+H2O,加入氨水,调pH为8,Fe3+完全沉淀时的pH为3.2,只有Fe3+完全沉淀,滤渣I为Fe(OH)3,溶液中主要含Ca2+、Mg2+、Ba2+,加入氢氧化钠调节pH=12.5,Ca2+开始沉淀的pH为11.9、完全沉淀时的pH为13.9,Mg2+完全沉淀时的pH为11.1,Mg2+完全沉淀,Ca2+部分沉淀,滤渣Ⅱ中含Mg(OH)2、Ca(OH)2;溶液中主要含Ca2+、Ba2+,加入H2C2O4,得到CaC2O4沉淀,除去Ca2+,蒸发浓缩冷却结晶得到BaCl22H2O。(1)根据影响反应速率的因素及实验操作过程分析解答;(2)根据提示信息中离子完全沉淀的pH值及Ksp分析解答;(3)根据滴定管的构造及滴定原理计算解答。
(1)化学反应的速率与反应物的接触面积有关,毒重石用盐酸浸取前需充分研磨,可以增大反应物的接触面积,增大反应速率,提高浸取效率;溶液中溶质的质量分数=![]() ,实验室用37%的盐酸配制15%的盐酸,需计算出浓盐酸的体积和水的体积,需用量筒量取,浓盐酸稀释为稀盐酸,需用烧杯作为容器稀释,选择a,玻璃棒搅拌加速溶解选择c,故答案为:增大接触面积,使反应速率加快,提高浸取效率;ac;
,实验室用37%的盐酸配制15%的盐酸,需计算出浓盐酸的体积和水的体积,需用量筒量取,浓盐酸稀释为稀盐酸,需用烧杯作为容器稀释,选择a,玻璃棒搅拌加速溶解选择c,故答案为:增大接触面积,使反应速率加快,提高浸取效率;ac;
(2)根据流程图和表中数据可知:Fe3+完全沉淀时的pH为3.2,加入氨水,调pH为8,Fe3++3NH3H2O=Fe(OH)3↓+3NH4+,Fe3+完全沉淀,滤渣I为Fe(OH)3,加入氢氧化钠调节pH=12.5,Ca2+开始沉淀的pH为11.9、完全沉淀时的pH为13.9,Mg2+完全沉淀时的pH为11.1,,Mg2+完全沉淀,Ca2+部分沉淀,滤渣Ⅱ中含Mg(OH)2、Ca(OH)2,溶液中主要含Ca2+、Ba2+,Ksp(BaC2O4)=1.6×107,Ksp(CaC2O4)=2.3×109,易形成CaC2O4沉淀,加入H2C2O4时应避免过量,防止CaC2O4沉淀完全后,过量的H2C2O4会导致生成BaC2O4沉淀,产品的产量减少,故答案为:Mg(OH)2、Ca(OH)2;H2C2O4过量会导致生成BaC2O4沉淀,产品的产量减少;
(3)无论酸式还是碱式滴定管,“0”刻度位于滴定管的上方;步骤Ⅱ:待Ba2+完全沉淀后,再加入酸碱指示剂,用bmol/L盐酸标准液滴定至终点,测得滴加盐酸的体积为V1mL,则发生2CrO42+2H+═Cr2O72+H2O的盐酸的物质的量为:V1×103L×bmol/L,步骤Ⅰ:用bmol/L盐酸标准液滴定至终点,测得滴加盐酸体积为V0mL,加入的总盐酸的物质的量:V0×103L×bmol/L,Ba2++CrO42═BaCrO4↓,与Ba2+反应的CrO42的物质的量为V0×103L×bmol/LV1×103L×bmol/L=(V0V1)×b×103mol,BaCl2溶液的体积为ymL,所以BaCl2溶液的浓度为:![]() ;若步骤Ⅱ中滴加盐酸时有少量待测液溅出,则测得V1偏小,则Ba2+浓度测量值将偏大;故答案为:上方;
;若步骤Ⅱ中滴加盐酸时有少量待测液溅出,则测得V1偏小,则Ba2+浓度测量值将偏大;故答案为:上方;![]() ;偏大。
;偏大。

【题目】已知常温下浓度为0.lmol/L的下列溶液的pH如下表,下列有关说法正确的是( )
溶质 | NaF | NaClO | Na2CO3 |
pH | 7.5 | 9.7 | 11.6 |
A.在相同温度下,同浓度的三种酸溶液的导电能力顺序: H2CO3< HClO<HF
B.向上述NaC1O溶液中通HF气体至恰好完全反应时:c(Na+)>c(F-)>(H+)>c(HClO) >c(OH-)
C.根据上表,水解方程式ClO-+H2O![]() HClO+OH-的水解常数K=10-7.6
HClO+OH-的水解常数K=10-7.6
D.若将CO2通入0.lmol/LNa2CO3溶液中至溶液中性,则溶液中2c(CO32-)+c(HCO3-)=0.1 mol/L
【题目】下列实验中的现象,与氧化还原反应无关的是
A | B | C | D | |
实验 | 酒精溶液滴入高锰酸钾溶液中 | 石蕊溶液滴入氯水中 |
| 常温下,铝片插入浓硫酸中 |
现象 | 高锰酸钾溶液褪色 | 溶液变红,随后迅速褪色 | 沉淀由黄色逐渐变为黑色 | 无明显现象 |
A.AB.BC.CD.D