题目内容
【题目】下列说法不正确的是( )
A.乙醚和乙醇互为同分异构体
B.苯与苯乙烯具有相同最简式但不是同系物
C.![]() 分子中最多可以有20个原子共平面
分子中最多可以有20个原子共平面
D.CH3CH2CH2CH3和C(CH3)4互为同系物
【答案】A
【解析】
A.乙醇为C2H5OH,乙醚为C2H5OC2H5,分子式不同,不互为同分异构体,故A错误;
B.苯与苯乙烯的最简式均为CH;结构相似,分子组成相差若干个CH2原子团的同一类物质互为同系物,苯与苯乙烯结构不相似,不是同系物,故B正确;
C.苯分子中12个原子共平面、甲烷为正四面体结构、乙烯分子中6个原子共平面、乙炔分子中4个原子在同一直线上可知,![]() 分子中最多可以有20个原子共平面(除两个甲基上分别有2个H原子外),故C正确;
分子中最多可以有20个原子共平面(除两个甲基上分别有2个H原子外),故C正确;
D.CH3CH2CH2CH3和C(CH3)4结构相似,分子组成相差1个CH2原子团,互为同系物,故D正确;
故选A。

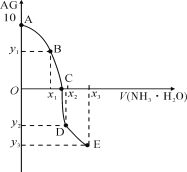
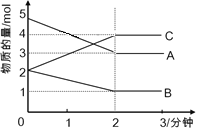
【题目】关于下列各图的叙述不正确的是( )
化学方程式 | 平衡常数K |
F2 + H2 = 2HF | 6.5×1095 |
Cl2 + H2 = 2HCl | 2.6×1033 |
Br2 + H2 = 2HBr | 1.9×1019 |
I2 + H2 = 2HI | 8.7×102 |
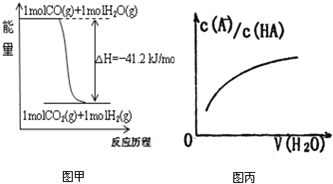
A.已知CO的燃烧热283kJ·mol-1,O2(g) +2 H2(g) = 2H2O(g) ΔH = -483.6 kJ·mol-1,则图甲表示CO和H2O(g)生成CO2和H2的能量变化
B.某温度下,pH =11的NH3H2O和pH =1的盐酸等体积混合后(不考虑混合后溶液体积的变化)恰好完全反应,反应后的溶液中NH4+、NH3H2O与NH3三种微粒的平衡浓度之和为0.05molL-1
C.在常温下,X2(g) 和 H2反应生成HX的平衡常数如表乙所示,仅依据K的变化,就可以说明在相同条件下,平衡时X2(从F2到I2)的转化率逐渐降低,且X2与H2反应的剧烈程度逐渐减弱
D.图丙中曲线表示常温下向弱酸HA的稀溶液中加水稀释过程中,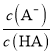 的变化情况
的变化情况
【题目】毒重石的主要成分 BaCO3(含 Ca2+、Mg2+、Fe3+等杂质),实验室利用毒重石制备 BaCl2·2H2O 的流程如下:
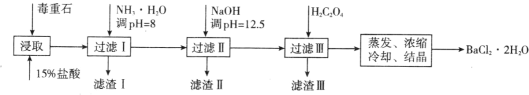
(1)毒重石用盐酸浸取前需充分研磨,目的是_______。实验室用 37%的盐酸配制 15%的盐酸,除量筒外还需使用下列仪器中的_______(填标号)。
a 烧杯 b 容量瓶 c 玻璃棒 d 滴定管
(2)
Ca2+ | Mg2 + | Fe3+ | |
开始沉淀时的 pH | 11.9 | 9.1 | 1.9 |
完全沉淀时的 pH | 13.9 | 11.1 | 3.2 |
流程中,滤渣Ⅱ中含_______(填化学式)。加入 H2C2O4 时应避免过量,原因是_______。 [已知:Ksp(BaC2O4)=1.6×10-7,Ksp(CaC2O4)=2.3×10-9]
(3)利用间接酸碱滴定法可测定 Ba2+的含量,实验分两步进行。已知:2CrO42-+2H+=Cr2O72-+H2O Ba2++CrO42-=BaCrO4↓
步骤Ⅰ:移取 xmL 一定浓度的 Na2CrO4 溶液与锥形瓶中,加入酸碱指示剂,用 b mol·L-1盐酸标准液滴定至终点,测得滴加盐酸体积为 V0 mL。
步骤Ⅱ:移取 y mLBaCl2 溶液于锥形瓶中,加入 x mL 与步骤Ⅰ相同浓度的 Na2CrO4 溶液,待 Ba2+完全沉淀后,再加入酸碱指示剂,用b mol·L-1盐酸标准液滴定至终点,测得滴加盐酸的体积为 V1 mL。滴加盐酸标准液时应用酸式滴定管,“0”刻度位于滴定管的_______(填“上方”或“下方”)。BaCl2 溶液的浓度为___________mol·L-1,若步骤Ⅱ中滴加盐酸时有少量待测液溅出,Ba2+浓度测量值将_______(填“偏大”或“偏小”或“无影响”)。