��Ŀ����
����Ŀ�����õ�ζ����������һ�ִӻ���������ȡ��ˮ�����ӷ����㾫�ͣ������Ҵ������ѵ��л��ܼ���������ͼ��ʾװ�ô��������ѷۣ��������ᴿ�õ������͡�
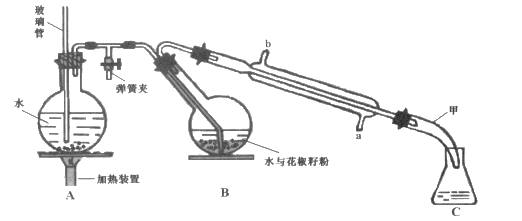
ʵ�鲽�裺
��һ����Aװ���е�Բ����ƿ��װ��![]() �ݻ���ˮ����1~2����ʯ��ͬʱ����B�е�Բ����ƿ�м���20g�����ѷۺ�50mLˮ��
�ݻ���ˮ����1~2����ʯ��ͬʱ����B�е�Բ����ƿ�м���20g�����ѷۺ�50mLˮ��
����������Aװ���е�Բ����ƿ�����д�����������ʱ�رյ��ɼУ���������
�����������Һ�м���ʳ�������ͣ�����15mL������ȡ2�Σ���������ȡ���Ѳ�ϲ�������������ˮNa2SO4����Һ���㵹��������ƿ�У�����û����͡�
(1)װ��A�в����ܵ�������_______��װ��B��Բ����ƿ��б��Ŀ���� ________��
(2)���裨�����У����۲쵽_______����ʱ����ֹͣ�����������ʱ�����в�����˳��Ϊ_______�����ţ���
��ֹͣ���Ȣڴ��ɼТ۹ر�����ˮ
(3)�����Һ�м���ʳ�ε�������__ ��������ˮNa2SO4��������_______��
(4)ʵ���������ϡNaOH��Һ��ϴ�����ܣ���Ӧ�Ļ�ѧ����ʽΪ_________������������![]() ��ʾ��
��ʾ��
(5)Ϊ�ⶨ����������֬�ĺ�����ȡ20.00mL�����������Ҵ��У���80.00mL0.5mol/LNaOH���Ҵ���Һ�����裬��ַ�Ӧ����ˮ���200mL��Һ��ȡ25.00mL�����̪����0.1moI/L������еζ����ζ��յ���������20.00mL����û������к�����֬_______ g/L��
����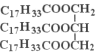 �ƣ�ʽ����884)��
�ƣ�ʽ����884)��
���𰸡�ƽ����ѹ������رյ��ɼк�Բ����ƿ����ѹ���� ��ֹ�ɽ����Һ�������������(��������) �����״����Һ����״Һ�� �ڢ٢� �����ͻ�������ˮ�е��ܽ�ȣ������ڷֲ� ��ȥ�������е�ˮ����� 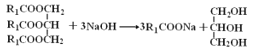 353.6g/L
353.6g/L
��������
��Aװ���м��Ȳ���ˮ������ˮ�����������ܽ���Bװ�ã���װ��B�л����ѷ���ˮ�Ļ������м�����ȡ�����ͣ������Һ�м���ʳ�ο������ɽ��ͻ�������ˮ�е��ܽ�ȣ����ڻ����ͷֲ����������ڻ����������ܽ����л��ܼ������У���������ˮ�������ܣ���������ȡ���к��еĻ����ͣ����������Ƴ�ȥ�Ѳ���������ˮ���������õ������͡����ݻ����͵���Ҫ�ɷ�������֬���ܹ���NaOH��Ӧ������֬�����ƺ��ͣ�������NaOH��HCl�ζ�����������к͵ζ���������к��еĻ����͵������������ɵû���������֬�ĺ�����
(1)����ʱ��ƿ������ѹǿ�������ܿɻ�������ѹǿ��ƽ����ѹ������رյ��ɼк�Բ����ƿ����ѹ����װ��B��Բ����ƿ��б���Է�ֹ�ɽ����Һ�������������(��������)��
(2)����Aװ���е�Բ����ƿ�����д�����������ʱ�رյ��ɼУ���������װ��B�еĻ����ͻ������ȵ�ˮ�������ϱ�Ϊ�����������������״����Һ����״Һ�壬˵����������ȫ�����������ʱֹͣ�����������ʱ�������Ǵ��ɼУ�Ȼ��ֹͣ���ȣ����ر�����ˮ���ʲ�����˳��Ϊ�ڢ٢ۣ�
(3)�����Һ�м���ʳ�ε�����������ˮ����ܶȣ����ͻ�������ˮ�е��ܽ�ȣ������ڷֲ㣻������ˮNa2SO4����������ˮNa2SO4��ˮ����γ�Na2SO410H2O���Ա��ڳ�ȥ�������е�ˮ��Ի����ͽ��и��
(4)ʵ���������ϡNaOH��Һ��ϴ�������ڱ���մ�е���֬�����߷�����Ӧ���������Եĸ�֬�����ƺ��ͣ��÷�Ӧ�Ļ�ѧ����ʽΪ ��
��
(5)����HCl+NaOH=NaCl+H2O������n(NaOH)(����)=n(HCl)=0.1mol/L��0.020L��![]() =0.016mol��������֬��Ӧ�����ʵ��������ʵ���Ϊ��0.5mol/L��0.08L-0.016mol=0.024mol�����ݻ�������NaOH��Ӧ�����ʵ��������ʵ�����ϵ��֪���к��еĻ����͵����ʵ���Ϊn(��֬)=
=0.016mol��������֬��Ӧ�����ʵ��������ʵ���Ϊ��0.5mol/L��0.08L-0.016mol=0.024mol�����ݻ�������NaOH��Ӧ�����ʵ��������ʵ�����ϵ��֪���к��еĻ����͵����ʵ���Ϊn(��֬)=![]() n(NaOH)=
n(NaOH)=![]() ��0.024mol=0.008mol��������Ϊm(��֬)=0.008mol��884g/mol=7.072g����û������к�����֬7.072g��0.02L=353.6g/L��
��0.024mol=0.008mol��������Ϊm(��֬)=0.008mol��884g/mol=7.072g����û������к�����֬7.072g��0.02L=353.6g/L��

 ��Ч���ܿ�ʱ��ҵϵ�д�
��Ч���ܿ�ʱ��ҵϵ�д�����Ŀ�����ǵ����Ϻ�����ḻ��һ��Ԫ�أ������仯�����ڹ�ũҵ������������������Ҫ���á���ش��������⣺��ͼ���漰����Ϊ��̬��

��1����ͼ��1mol NO2��1mol CO��Ӧ����CO2��NO�����������仯ʾ��ͼ����д��NO2��CO��Ӧ���Ȼ�ѧ����ʽ______��
��2����0.5L���ܱ������У�һ�����ĵ����������������»�ѧ��Ӧ��N2��g��+3H2��g��![]() 2NH3��g����H��0���仯ѧƽ�ⳣ��K���¶�t�Ĺ�ϵ���±���
2NH3��g����H��0���仯ѧƽ�ⳣ��K���¶�t�Ĺ�ϵ���±���
t/�� | 200 | 300 | 400 |
K | K1 | K2 | 0.5 |
������������⣺
���ԱȽ�K1��K2�Ĵ�С��K1______K2����д����������=��������������
�����и�������Ϊ�жϸ÷�Ӧ�ﵽ��ѧƽ��״̬��������_______���������ĸ����
a .������N2��H2��NH3��Ũ��֮��Ϊ1��3��2 b. ����N2����=3����H2����
c .������ѹǿ���ֲ��� d. ���������ܶȱ��ֲ���
����400��ʱ�������NH3��N2��H2�����ʵ����ֱ�Ϊ1mol��2mol��3molʱ����÷�Ӧ������N2����______����N2��������д��������=��������������
����Ŀ����ijѧ������֪���ʵ���Ũ�ȵ��������ⶨδ֪���ʵ���Ũ�ȵ�NaOH��Һʱ��ѡ���̪��ָʾ�����ش��������⣺
��1���ñ�������ζ������NaOH��Һʱ���յ�������_______��
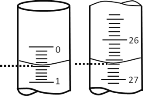
��2�����ζ���ʼ�ͽ���ʱ����ʽ�ζ����е�Һ����ͼ��ʾ����ζ�����ʱ�Ķ���Ϊ___________ mL������������Һ�����Ϊ_______mL��
�ζ����� | ����NaOH��Һ�����/mL | 0.1000mol��L��1��������/mL | ||
�ζ�ǰ�̶� | �ζ���̶� | ��Һ���/mL | ||
��һ�� | 25.00 | 0.00 | 26.11 | 26.11 |
�ڶ��� | 25.00 | 1.56 | 30.30 | 28.74 |
������ | 25.00 | 0.22 | 26.31 | 26.09 |
��3��ijѧ������3��ʵ��ֱ��¼�й��������±���
�����ϱ����ݼ���ɵø�NaOH��Һ�����ʵ���Ũ��Ϊ___mol��L��1��������λ��Ч���֣���
��4�����в����п���ʹ����NaOH��Һ��Ũ����ֵƫ�͵���_____������ĸ����
A����ʽ�ζ���δ�ñ�������ϴ��ֱ��ע�������
B����ȡ�������ʱ����ʼ���Ӷ������ζ�����ʱ���Ӷ���
C����ʽ�ζ����ڵζ�ǰ�����ݣ��ζ���������ʧ
D����ƿ��ˮϴ�Ӻ��ô���Һ��ϴ
��5������к͵ζ�ԭ��Ҳ�������������͵ĵζ����磺һ�ֲⶨˮ����Br����Ũ�ȵ�ʵ�鲽�����£�
������ƿ�м��봦�����ˮ��25.00mL�����뼸��NH4Fe(SO4)2��Һ��
�ڼ���V1mL c1 mol/L AgNO3��Һ�������������ҡ�ȡ�
����c2mol/L KSCN����Һ���еζ������յ�ʱ���ı���ҺV2mL��
�����ˮ����Br�������ʵ���Ũ��Ϊ_______mol��L��1����֪��Ksp(AgBr��= 7.7��10��13��Ag++ SCN��=AgSCN(��ɫ)�� ��Ksp(AgSCN)= 1��10��12����
��ijʵ��С����0.50 mol/L NaOH��Һ��0.50 mol/L������Һ�����к��ȵIJⶨ��ʵ��װ����ͼ��ʾ��
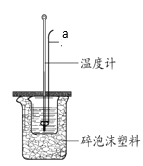
��6������a��������_______��
��7��ȡ50 mL NaOH��Һ��30 mL������Һ����ʵ�飬�����ֹ�¶Ȳ��ƽ��ֵΪ4.0�档������Ϊ0.50 mol/L NaOH��Һ��0.50 mol/L������Һ���ܶȶ���1 g/cm3���ͺ�������Һ�ı�����c��4.18 J/(g����)���������к�����H��______(ȡС�����һλ)��
��8������ʵ�����룭57.3 kJ/mol��ƫ�����ƫ���ԭ�������_____ (����ĸ)��
a��ʵ��װ�ñ��¡�����Ч����
b������Ͳ��ȡNaOH��Һ�����ʱ���ӿ̶��߶���
c���ֶ�ΰ�NaOH��Һ����ʢ�������С�ձ���
d�����¶ȼƲⶨNaOH��Һ��ʼ�¶Ⱥ�ֱ�ӲⶨH2SO4��Һ���¶�
����Ŀ���±��Dz�ͬ�¶���ˮ�����ӻ�������
�¶�/�� | 25 |
|
|
ˮ�����ӻ����� |
| a |
|
�Իش��������⣺
��1����![]() �����________���������������������
�����________���������������������![]() ���������жϵ�������________________��
���������жϵ�������________________��
��2��![]() �£�ij
�£�ij![]() ��Һ��
��Һ��![]() ��ȡ����Һ
��ȡ����Һ![]() ����ˮϡ����
����ˮϡ����![]() ����ϡ�ͺ���Һ��
����ϡ�ͺ���Һ��![]() ________��
________��
��3��![]() �£���
�£���![]() �Ŀ�������Һ
�Ŀ�������Һ![]() ��
��![]() ��ϡ����
��ϡ����![]() ��ϣ����Ϻ���Һ�����Ϊԭ����Һ���֮�ͣ������û����Һ��
��ϣ����Ϻ���Һ�����Ϊԭ����Һ���֮�ͣ������û����Һ��![]() ����
����![]() ________������Һ�и������ӵ�Ũ���ɴ�С������˳����___________��
________������Һ�и������ӵ�Ũ���ɴ�С������˳����___________��
����Ŀ������ʯ����Ҫ�ɷ� BaCO3���� Ca2+��Mg2+��Fe3+�����ʣ���ʵ�������ö���ʯ�Ʊ� BaCl2��2H2O ���������£�
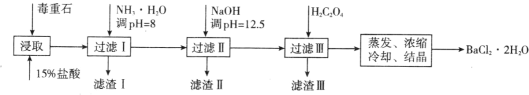
��1������ʯ�������ȡǰ������ĥ��Ŀ����_______��ʵ������ 37%���������� 15%�����ᣬ����Ͳ���ʹ�����������е�_______�����ţ���
a �ձ� b ����ƿ c ������ d �ζ���
��2��
Ca2+ | Mg2 + | Fe3+ | |
��ʼ����ʱ�� pH | 11.9 | 9.1 | 1.9 |
��ȫ����ʱ�� pH | 13.9 | 11.1 | 3.2 |
�����У��������к�_______���ѧʽ�������� H2C2O4 ʱӦ���������ԭ����_______�� [��֪��Ksp��BaC2O4����1.6��10-7��Ksp��CaC2O4����2.3��10-9]
��3�����ü�����ζ����ɲⶨ Ba2+�ĺ�����ʵ����������С���֪��2CrO42-��2H+��Cr2O72-��H2O Ba2+��CrO42-��BaCrO4��
�������ȡ xmL һ��Ũ�ȵ� Na2CrO4 ��Һ����ƿ�У��������ָʾ������ b mol��L-1�����Һ�ζ����յ㣬��õμ��������Ϊ V0 mL��
�������ȡ y mLBaCl2 ��Һ����ƿ�У����� x mL �벽�����ͬŨ�ȵ� Na2CrO4 ��Һ���� Ba2+��ȫ�������ټ������ָʾ������b mol��L-1�����Һ�ζ����յ㣬��õμ���������Ϊ V1 mL���μ������ҺʱӦ����ʽ�ζ��ܣ���0���̶�λ�ڵζ��ܵ�_______�������Ϸ��������·�������BaCl2 ��Һ��Ũ��Ϊ___________mol��L-1����������еμ�����ʱ����������Һ������Ba2+Ũ�Ȳ���ֵ��_______������ƫ��������ƫС��������Ӱ��������