题目内容
11.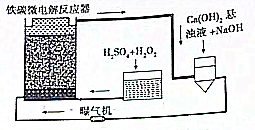 铁碳微电解技术是近年来处理各种污水的一种重要方法,其装置如图所示.
铁碳微电解技术是近年来处理各种污水的一种重要方法,其装置如图所示.请回答下列问题:
(1)当污水通过铁碳微电解反应器时,会形成数量巨大的微小电池,这些微小电池的负极为铁,若污水为酸性溶液,且通过曝气机鼓入充足的空气,正极反应式为O2+4H++4e-=2H2O;
(2)铁碳微电解操作过程中一般需要加入适量的H2O2,H2O2在电池反应产生的Fe2+的催化作用下,将废水中的有机物氧化为无害的物质,写出H2O2以Fe2+为催化剂氧化乙酸乙酯的化学方程式:10H2O2+CH3COOCH2CH3$\frac{\underline{\;催化剂\;}}{\;}$4CO2↑+14H2O,装置图中Ca(OH)2悬浊液+NaOH”的作用是消耗反应生成的二氧化碳;
(3)实验中配制FeCl3溶液时,除氧化铁晶体外,还需要的试剂最合适的是c.
a、蒸馏水
b、铁粉与蒸馏水
c、稀盐酸
d、铁粉与稀盐酸
采用上述所选试剂的理由是抑制Fe3+的水解,防止Fe3+变质,除去FeCl3溶液中的FeCl2的方法是2Fe2++Cl2=2Fe3++2Cl-(用离子方程式表示).
分析 (1)根据微小电池的组成,铁为负极,碳为正极,正极为氧气得电子的还原反应;
(2)根据双氧水具有强氧化性,将乙酸乙酯氧化成二氧化碳和水,根据“Ca(OH)2悬浊液+NaOH”具有碱性,可以中和酸来分析;
(3)FeCl3为强酸弱碱盐,水解呈酸性,配制FeCl3溶液时应加入盐酸抑制FeCl3水解,除去FeCl3溶液中的FeCl2的方法是通入氯气将二价铁氧化成三价铁,据此分析解答.
解答 解:(1)当污水通过铁碳微电解反应器时,会形成数量巨大的微小电池,所以铁为负极,碳为正极,若污水为酸性溶液,鼓入充足的空气,正极反应式为:O2+4H++4e-=2H2O,故答案为:铁;O2+4H++4e-=2H2O;
(2)双氧水具有强氧化性,将乙酸乙酯氧化成二氧化碳和水,化学方程式为:10H2O2+CH3COOCH2CH3$\frac{\underline{\;催化剂\;}}{\;}$4CO2↑+14H2O;“Ca(OH)2悬浊液+NaOH”具有碱性,可以消耗反应生成的二氧化碳,故答案为:10H2O2+CH3COOCH2CH3$\frac{\underline{\;催化剂\;}}{\;}$4CO2↑+14H2O;消耗反应生成的二氧化碳;
(3)FeCl3为强酸弱碱盐,水解呈酸性,配制FeCl3溶液时应加入盐酸抑制FeCl3水解;
除去FeCl3溶液中的FeCl2的方法是通入氯气将二价铁氧化成三价铁,离子方程式为:2Fe2++Cl2=2Fe3++2Cl-;
故答案为:c;抑制Fe3+的水解,防止Fe3+变质;2Fe2++Cl2=2Fe3++2Cl-.
点评 本题考查了原电池的原理、氧化还原反应方程式的书写以及盐的水解原理的应用,属于基础知识的考查,题目难度不大;

练习册系列答案
 小学课时作业全通练案系列答案
小学课时作业全通练案系列答案 金版课堂课时训练系列答案
金版课堂课时训练系列答案
相关题目
1.常温下,下列各组离子在指定溶液中一定能大量共存的是( )
| A. | KI溶液中:Ca2+、Na+、ClO-、Cl- | |
| B. | 滴入酚酞试液显红色的溶液中:Al3+、K+、AlO2-、SO42- | |
| C. | c(H+)=10-12mol•L-1的溶液中:K+、Na+、NO3-、Cl- | |
| D. | 加入铝粉产生氢气的溶液中:Na+、Mg2+、HCO3-、SO42- |
2.根据元素周期律,由列事实进行归纳推测,推测不合理的是事实( )
| 事实 | 推测 | |
| A | 12Mg与水反应缓慢,20Ca与水反应较快 | 56Ba(IIA族)与水反应更快 |
| B | Si是半导体材料,同族Ge也是半导体材料 | Ⅳ族的元素都是半导体材料, |
| C | HCl在1500℃时分解,HI在230℃时分解 | HBr的分解温度介于二者之间 |
| D | Si与H2高温时反应,S与H2加热能反应 | P与H2在高温时能反应 |
| A. | A | B. | B | C. | C | D. | D |
19.利用右图所示装置进行下列实验,能得出相应实验结论的是( )
| 选项 | ① | ② | ③ | 实验结论 | 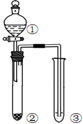 |
| A | NaCl溶液 | 电石 | 酸性KMnO4 | 乙炔具有还原性 | |
| B | 浓硝酸 | Na2CO3 | 苯酚钠溶液 | 酸性:硝酸>碳酸>苯酚 | |
| C | 浓盐酸 | KMnO4 | FeBr2 | 氧化性:Cl2>Br2 | |
| D | 浓硫酸 | 蔗糖 | 溴水 | 浓硫酸具有脱水性、氧化性 |
| A. | A | B. | B | C. | C | D. | D |
16. A~H元素在元素周期表中的相对位置如图.A与E的原子序数相差3,E的一种单质是自然界中硬度最大的物质,D与H属同周期元素.下列判断正确的是( )
A~H元素在元素周期表中的相对位置如图.A与E的原子序数相差3,E的一种单质是自然界中硬度最大的物质,D与H属同周期元素.下列判断正确的是( )
 A~H元素在元素周期表中的相对位置如图.A与E的原子序数相差3,E的一种单质是自然界中硬度最大的物质,D与H属同周期元素.下列判断正确的是( )
A~H元素在元素周期表中的相对位置如图.A与E的原子序数相差3,E的一种单质是自然界中硬度最大的物质,D与H属同周期元素.下列判断正确的是( )| A. | 原子半径:H>F>E | |
| B. | 金属性:A>B>D | |
| C. | C与G的原子核外电子数相差3 | |
| D. | B的单质在空气中燃烧生成只含离子键的化合物 |
3.用下列实验装置进行相应实验,能达到实验目的是(夹持装置未画出)( )
| A. | 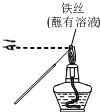 用装置甲检验溶液中是否有K+ | B. | 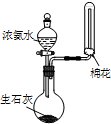 用装置乙制取并收集少量NH3 | ||
| C. |  用装置丙进行喷泉实验 | D. |  用装置丁加热熔融NaOH固体 |