题目内容
1.电化学降解NO的原理如图所示.下列说法中正确的是( )
| A. | 铅蓄电池的A极为负极,电极材料为Pb | |
| B. | 铅蓄电池工作过程中每通过电路中2mol电子则消耗1molH2SO4 | |
| C. | 该电解池的阴极反应为 2NO3-+6H2O+10e-=N2↑+12OH- | |
| D. | 若电解过程中转移5moL电子,则交换膜两侧电解液的质量变化差(△m左-△m右)为14.4g |
分析 A.依据图中Ag-Pt电极,硝酸根离子得到电子生成氮气,发生还原反应,可知Ag-Pt为电解池的阴极,B为电源的负极;
B.依据铅蓄电池放电时反应Pb+PbO2+2H2SO4═2PbSO4+2H2O解答;
C.阴极上硝酸根离子得电子发生还原反应,电极反应式为2NO3-+6H2O+10e-=N2↑+12OH-;
D.转移1mol电子时,阳极(阳极反应为H2O失电子氧化为O2和H+)消耗0.5mol水,产生1molH+进入阴极室,阳极室质量减少9g;阴极室中放出0.1molN2(2.8g),同时有1molH+(1g)进入阴极室.
解答 解:A.该装置中,硝酸根离子得电子发生还原反应,则Ag-Pt电极为阴极、Pt电极为阳极,连接阴极的B电极为负极,A为正极,故A错误;
B.铅蓄电池放电时方程式Pb+PbO2+2H2SO4═2PbSO4+2H2O,所以每通过电路中2mol电子则消耗2molH2SO4,故B错误;
C.阴极上硝酸根离子得电子发生还原反应,电极反应式为2NO3-+6H2O+10e-=N2↑+12OH-,故C正确;
D.转移1mol电子时,阳极(阳极反应为H2O失电子氧化为O2和H+)消耗0.5mol水,产生1molH+进入阴极室,阳极室质量减少9g;阴极室中放出0.1molN2(2.8g),同时有1molH+(1g)进入阴极室,因此阴极室质量减少1.8g,故膜两侧电解液的质量变化差(△m左-△m右)=9g-1.8g=7.2g,则转移5mol电子膜两侧电解液的质量变化差(△m左-△m右)=7.2g×5=36g,故D错误;
故选:C.
点评 本题考查了电解池、原电池工作原理、电极反应式的书写及有关计算,题目难度中等,准确判断电极及发生的反应是解题关键.

练习册系列答案
 开心练习课课练与单元检测系列答案
开心练习课课练与单元检测系列答案
相关题目
12.氨基甲酸铵(NH2COONH4)是一种白色固体,易分解、易水解,可用做肥料、灭火剂、洗涤剂等.某化学兴趣小组用模拟制备氨基
甲酸铵,反应的化学方程式如下:2NH3(g)+CO2(g)?NH2COONH4(s)△H<0
(1)如用如图1装置制取氨气,你所选择的试剂是浓氨水与生石灰或氢氧化钠固体等.
(2)制备氨基甲酸铵的装置如图2所示,把氨气和二氧化碳通入四氯化碳中,不断搅拌混合,生成的氨基甲酸铵小晶体悬浮在四氯化碳中. 当悬浮物较多时,停止制备.
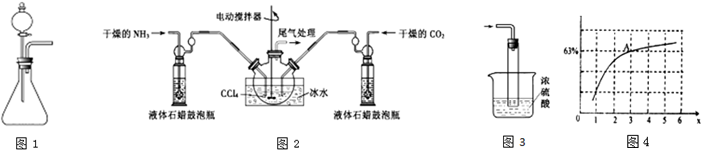
注:四氯化碳与液体石蜡均为惰性介质.
①制备氨基甲酸铵时温度不能高,该实验中控温措施有哪些搅拌、冰水浴、控制通入气体流速.
②从反应后的混合物中分离出产品的实验方法是过滤(填写操作名称).为了得到干燥产品,应采取的方法是c(填写选项序号).
a.常压加热烘干 b.高压加热烘干 c.真空40℃以下烘干
③尾气处理装置如右图所示.双通玻璃管的作用:防止倒吸;浓硫酸的作用:吸收多余氨气、防止空气中水蒸气进入反应器使氨基甲酸铵水解
(3)取因部分变质而混有碳酸氢铵的氨基甲酸铵样品0.782 0g,用足量石灰水充分处理后,使碳元素完全转化为碳酸钙,过滤、洗涤、干燥,测得质量为1.000g.则样品中氨基甲酸铵的物质的量分数为80.00%.
[Mr(NH2COONH4)=78、Mr(NH4HCO3)=79、Mr(CaCO3)=100]
(4)以NH3和CO2为原料在工业上生产尿素的原理是:2NH3(g)+CO2(g)?CO(NH2)(I)+H2O(I),该反应的平衡常数和温度关系如下:
①焓变△H<0(填“>”、“<”或“=”).
②在一定温度和压强下,若原料气中的NH3和CO2的物质的量之比(氨碳比),
如图4是氨碳比(x),$\frac{n(N{H}_{3})}{n(C{O}_{2})}$=x与CO2平衡转化率(a)的关系.
a随着x增大而增大的原因是NH3的量增大,平衡正向移动,则增大CO2的转化率.,图中A点处NH3的平衡转化率为42%.
甲酸铵,反应的化学方程式如下:2NH3(g)+CO2(g)?NH2COONH4(s)△H<0
(1)如用如图1装置制取氨气,你所选择的试剂是浓氨水与生石灰或氢氧化钠固体等.
(2)制备氨基甲酸铵的装置如图2所示,把氨气和二氧化碳通入四氯化碳中,不断搅拌混合,生成的氨基甲酸铵小晶体悬浮在四氯化碳中. 当悬浮物较多时,停止制备.

注:四氯化碳与液体石蜡均为惰性介质.
①制备氨基甲酸铵时温度不能高,该实验中控温措施有哪些搅拌、冰水浴、控制通入气体流速.
②从反应后的混合物中分离出产品的实验方法是过滤(填写操作名称).为了得到干燥产品,应采取的方法是c(填写选项序号).
a.常压加热烘干 b.高压加热烘干 c.真空40℃以下烘干
③尾气处理装置如右图所示.双通玻璃管的作用:防止倒吸;浓硫酸的作用:吸收多余氨气、防止空气中水蒸气进入反应器使氨基甲酸铵水解
(3)取因部分变质而混有碳酸氢铵的氨基甲酸铵样品0.782 0g,用足量石灰水充分处理后,使碳元素完全转化为碳酸钙,过滤、洗涤、干燥,测得质量为1.000g.则样品中氨基甲酸铵的物质的量分数为80.00%.
[Mr(NH2COONH4)=78、Mr(NH4HCO3)=79、Mr(CaCO3)=100]
(4)以NH3和CO2为原料在工业上生产尿素的原理是:2NH3(g)+CO2(g)?CO(NH2)(I)+H2O(I),该反应的平衡常数和温度关系如下:
| T/℃ | 165 | 175 | 185 | 195 |
| K | 111.9 | 74.1 | 50.6 | 34.8 |
②在一定温度和压强下,若原料气中的NH3和CO2的物质的量之比(氨碳比),
如图4是氨碳比(x),$\frac{n(N{H}_{3})}{n(C{O}_{2})}$=x与CO2平衡转化率(a)的关系.
a随着x增大而增大的原因是NH3的量增大,平衡正向移动,则增大CO2的转化率.,图中A点处NH3的平衡转化率为42%.
16. 甲醇是重要的化学工业基础原料和清洁液体燃料.工业上可利用CO或CO2来生产燃料甲醇.已知甲醇制备的有关化学反应以及在不同温度下的化学反应平衡常数如下表所示:
甲醇是重要的化学工业基础原料和清洁液体燃料.工业上可利用CO或CO2来生产燃料甲醇.已知甲醇制备的有关化学反应以及在不同温度下的化学反应平衡常数如下表所示:
(1)据反应①与②可推导出K1、K2与K3之间的关系,则K3=K1•K2(用K1、K2表示).500℃时测得反应③在某时刻,H2(g)、CO2(g)、CH3OH(g)、H2O (g)的浓度(mol/L)分别为0.8、0.1、0.3、0.15,
则此时 V正> V逆(填“>”、“=”或“<”).
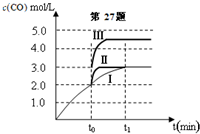
(2)在3L容积可变的密闭容器中发生反应②,已知c(CO)-反应时间t变化曲线Ⅰ如图所示,若在t0时刻分别改变一个条件,曲线Ⅰ变为曲线Ⅱ和曲线Ⅲ.
当曲线Ⅰ变为曲线Ⅱ时,改变的条件是加入催化剂.
当曲线Ⅰ变为曲线Ⅲ时,改变的条件是将容器的体积快速压缩至2L.
(3)一定条件下甲醇与一氧化碳反应可以合成乙酸.通常状况下,将a mol/L的醋酸与b mol/LBa(OH)2溶液等体积混合,反应平衡时,2c(Ba2+)=c(CH3COO-),用含a和b的代数式表示该混合溶液中醋酸的电离常数为$\frac{2b}{a-2b}$×10-7.
 甲醇是重要的化学工业基础原料和清洁液体燃料.工业上可利用CO或CO2来生产燃料甲醇.已知甲醇制备的有关化学反应以及在不同温度下的化学反应平衡常数如下表所示:
甲醇是重要的化学工业基础原料和清洁液体燃料.工业上可利用CO或CO2来生产燃料甲醇.已知甲醇制备的有关化学反应以及在不同温度下的化学反应平衡常数如下表所示:| 化学反应 | 平衡常数 | 温度℃ | |
| 500 | 800 | ||
| ①2H2(g)+CO(g)?CH3OH(g) | K1 | 2.5 | 0.15 |
| ②H2(g)+CO2(g)?H2O (g)+CO(g) | K2 | 1.0 | 2.50 |
| ③3H2(g)+CO2(g)?CH3OH(g)+H2O (g) | K3 | ||
则此时 V正> V逆(填“>”、“=”或“<”).
(2)在3L容积可变的密闭容器中发生反应②,已知c(CO)-反应时间t变化曲线Ⅰ如图所示,若在t0时刻分别改变一个条件,曲线Ⅰ变为曲线Ⅱ和曲线Ⅲ.
当曲线Ⅰ变为曲线Ⅱ时,改变的条件是加入催化剂.
当曲线Ⅰ变为曲线Ⅲ时,改变的条件是将容器的体积快速压缩至2L.
(3)一定条件下甲醇与一氧化碳反应可以合成乙酸.通常状况下,将a mol/L的醋酸与b mol/LBa(OH)2溶液等体积混合,反应平衡时,2c(Ba2+)=c(CH3COO-),用含a和b的代数式表示该混合溶液中醋酸的电离常数为$\frac{2b}{a-2b}$×10-7.
6.下列离子方程式书写正确的是( )
| A. | 澄清的石灰水与稀盐酸反应:Ca(OH)2+2H+=Ca2++2H2O | |
| B. | 氢氧化钡溶液与稀硫酸的反应:OH-+H+=H2O | |
| C. | 用FeCl3溶液腐蚀印刷电路板上铜箔:2Fe3++Cu=2Fe+Cu2+ | |
| D. | 碳酸钙溶于稀盐酸中:CaCO3+2H+=Ca2++H2O+CO2↑ |
13.下列关于Li、Na、K、Rb、Cs的叙述中正确的是( )
| A. | 其氢氧化物中碱性最强的是LiOH | |
| B. | 离子的氧化能力最强的是Cs+ | |
| C. | 原子半径随核电荷数的增大而增大 | |
| D. | 单质的熔点随相对原子质量的增大而增大 |
10.甲、乙是元素周期表中同一周期的两种元素,甲位于ⅡA族,其原子序数为x,乙位于ⅢA族,则乙的原子序数可能是( )
①x+1 ②x+11 ③x+25 ④x+26 ⑤x+10.
①x+1 ②x+11 ③x+25 ④x+26 ⑤x+10.
| A. | ① | B. | ②③ | C. | ①②③ | D. | 全部 |
11.下列说法中,正确的是( )
| A. | 氯乙烯、聚乙烯、苯乙炔都是不饱和烃 | |
| B. | 苯能与溴水在一定条件下发生取代反应 | |
| C. | 减少化石燃料使用,有利于降低空气中PM2.5(直径2.5μm以下细颗粒物)的含量 | |
| D. | 乙烯、苯、甲苯都能使高锰酸钾溶液褪色 |
