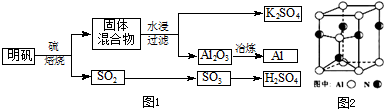
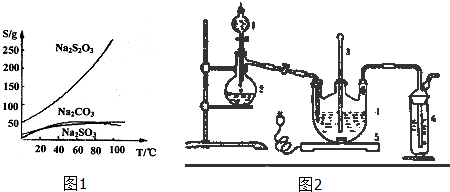
题目内容
3.由软锰矿(主要成分为MnO2)制备KMnO4的实验流程可表示如图1: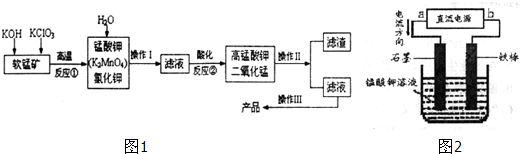
(1)操作Ⅱ的名称是过滤.
(2)可循环利用的物质MnO2(填化学式).
(3)反应②的产物中,氧化产物与还原产物的物质的量之比是2:1.
(4)反应②中“酸化”时不能选择下列酸中的A(填字母序号)
A.稀盐酸 B.稀硫酸 C.稀醋酸
(5)电解猛酸钾溶液也可以得到高锰酸钾,其阴极反应式为:2H2O+2e-=2OH-+H2↑如图2,b作负极,电解池的阳极反应式是MnO42--e-=MnO4-;若电解过程中收集到2.24L H2 (标准状况),则得到高锰酸 钾31.6克.(提示:阴离子放电顺序Mn2-4>OH-)
分析 由流程可知,第一步,KOH和KClO3与MnO2反应,得到K2MnO4,从而可以写出反应方程式为6KOH+3MnO2+KClO3=3K2MnO4+KCl+3H2O,然后加入水溶解分离可溶性物质,得到K2MnO4和KCl;第二步,将滤液酸化,得到高锰酸钾和二氧化锰,为一歧化反应,锰从+6变为+7和+4;反应方程式为3MnO42-+4H+=2MnO4-+MnO2+2H2O,通过过滤分离MnO2和高锰酸钾溶液,最终得到产品,整个过程中MnO2可以循环利用.
(1)操作Ⅱ是固体和液体分离,利用过滤操作分离;
(2)流程中参与反应过程,最后又重新生成的物质可以循环使用;
(3)反应②3MnO42-+4H+=2MnO4-+MnO2+2H2O,依据元素化合价变化分析,氧化产物是元素化合价升高的产物,元素化合价降低的产物为还原产物;
(4)因锰酸根和高锰酸根均具有强氧化性,不能使用盐酸酸化;
(5)由电流流向可知a为正极,铁为活性电极,这里没有参与反应,做阴极故与负极相连,阳极发生氧化反应,锰酸根失电子生成高锰酸根,根据电子得失守恒可以进行相关计算.
解答 解:由流程可知,第一步,KOH和KClO3与MnO2反应,得到K2MnO4,从而可以写出反应方程式为6KOH+3MnO2+KClO3=3K2MnO4+KCl+3H2O,然后加入水溶解分离可溶性物质,得到K2MnO4和KCl;第二步,将滤液酸化,得到高锰酸钾和二氧化锰,为一歧化反应,锰从+6变为+7和+4;反应方程式为3MnO42-+4H+=2MnO4-+MnO2+2H2O,通过过滤分离MnO2和高锰酸钾溶液,最终得到产品,整个过程中MnO2可以循环利用.
(1)操作Ⅱ是固体和液体分离,利用过滤操作分离,所以操作Ⅱ的名称是过滤,故答案为:过滤;
(2)流程中参与反应过程,最后又重新生成的物质可以循环使用,流程中KOH和KClO3与MnO2反应,将滤液酸化,得到高锰酸钾和二氧化锰,整个过程中MnO2可以循环利用,故答案为:MnO2;
(3)反应②为:3MnO42-+4H+=2MnO4-+MnO2+2H2O,反应中锰元素化合价从+6变为+7和+4;得到氧化产物为MnO4-,还原产物为MnO2,物质的量之比为2:1;
故答案为:2:1;
(4)因锰酸根和高锰酸根均具有强氧化性,盐酸中氯离子具有还原性,能被氧化,不能使用盐酸酸化,故答案为:A;
(5)装置图中的电流方向可知,铁为活性电极,这里没有参与反应,做阴极故与负极相连,b做负极,a为正极,石墨电极为阳极发生氧化反应,锰酸根失电子生成高锰酸根,电极反应为:MnO42--e-=MnO4-;根据电子得失守恒可以进行相关计算,若电解过程中收集到2.24L H2 (标准状况),物质的量=$\frac{2.24L}{22.4L/mol}$=0.1mol,电极反应为:2H++2e-=H2↑,结合电子守恒可知:
2MnO4-~2e-~H2,
2 1
0.2mol 0.1mol
得到高锰酸钾质量=0.2mol×158g/mol=31.6g;
故答案为:负;MnO42--e-=MnO4-;31.6.
点评 本题考查了物质制备流程分析判断,电解原理的分析应用,物质性质的理解应用和实验基本操作的掌握,工艺流程题解题的关键是要搞清楚加入什么物质,发生什么反应,如何分离等,通过分析,我们要能够将一个工艺的流程转化为物质的流程,题目难度中等.

| A. |  用装置甲检验溶液中是否有K+ | B. | 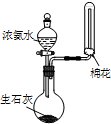 用装置乙制取并收集少量NH3 | ||
| C. | 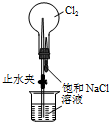 用装置丙进行喷泉实验 | D. |  用装置丁加热熔融NaOH固体 |
 ,下列相关说法中不正确的是( )
,下列相关说法中不正确的是( )| A. | 一定条件下能发生酯化反应 | |
| B. | 一定条件下能发生催化氧化反应 | |
| C. | 不能发生加成反应 | |
| D. | 1mol该物质与Na2CO3溶液反应最多消耗1.5mol Na2CO3 |
甲酸铵,反应的化学方程式如下:2NH3(g)+CO2(g)?NH2COONH4(s)△H<0
(1)如用如图1装置制取氨气,你所选择的试剂是浓氨水与生石灰或氢氧化钠固体等.
(2)制备氨基甲酸铵的装置如图2所示,把氨气和二氧化碳通入四氯化碳中,不断搅拌混合,生成的氨基甲酸铵小晶体悬浮在四氯化碳中. 当悬浮物较多时,停止制备.
注:四氯化碳与液体石蜡均为惰性介质.
①制备氨基甲酸铵时温度不能高,该实验中控温措施有哪些搅拌、冰水浴、控制通入气体流速.
②从反应后的混合物中分离出产品的实验方法是过滤(填写操作名称).为了得到干燥产品,应采取的方法是c(填写选项序号).
a.常压加热烘干 b.高压加热烘干 c.真空40℃以下烘干
③尾气处理装置如右图所示.双通玻璃管的作用:防止倒吸;浓硫酸的作用:吸收多余氨气、防止空气中水蒸气进入反应器使氨基甲酸铵水解
(3)取因部分变质而混有碳酸氢铵的氨基甲酸铵样品0.782 0g,用足量石灰水充分处理后,使碳元素完全转化为碳酸钙,过滤、洗涤、干燥,测得质量为1.000g.则样品中氨基甲酸铵的物质的量分数为80.00%.
[Mr(NH2COONH4)=78、Mr(NH4HCO3)=79、Mr(CaCO3)=100]
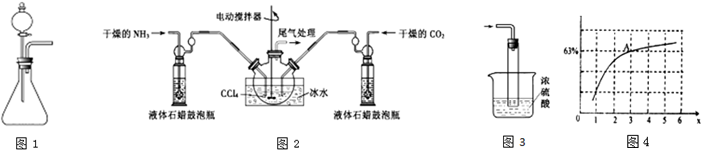
(4)以NH3和CO2为原料在工业上生产尿素的原理是:2NH3(g)+CO2(g)?CO(NH2)(I)+H2O(I),该反应的平衡常数和温度关系如下:
| T/℃ | 165 | 175 | 185 | 195 |
| K | 111.9 | 74.1 | 50.6 | 34.8 |
②在一定温度和压强下,若原料气中的NH3和CO2的物质的量之比(氨碳比),
如图4是氨碳比(x),$\frac{n(N{H}_{3})}{n(C{O}_{2})}$=x与CO2平衡转化率(a)的关系.
a随着x增大而增大的原因是NH3的量增大,平衡正向移动,则增大CO2的转化率.,图中A点处NH3的平衡转化率为42%.
| A. | 其氢氧化物中碱性最强的是LiOH | |
| B. | 离子的氧化能力最强的是Cs+ | |
| C. | 原子半径随核电荷数的增大而增大 | |
| D. | 单质的熔点随相对原子质量的增大而增大 |