题目内容
将amol小苏打和bmol过氧化钠置于某体积可变的密闭容器中充分加热,反应后测得容器内的氧气为1 mol,下列说法一定正确的是
| A.b="2" |
| B.反应中转移的电子数一定为2NA |
| C.容器中一定没有残余的CO2和水蒸气 |
| D.a:b≥1 |
B
解析试题分析:由反应:2Na2O2+2H2O= 4NaOH+O2,2Na2O2+2 CO2= 2Na2CO3+O2,知2Na2O2→O2,A、只要被反应的Na2O2为2mol即可,错误;B、反应的Na2O2为2mol,转移的电子数一定为2NA,正确;C、若加入Na2O2仅为2mol,即使有残余的CO2和水蒸气,产生的氧气为1 mol,错误;D、被反应的Na2O2为2mol,共需要CO2+ H2O 2mol,结合反应2NaHCO3 Na2CO3+ CO2+ H2O,需NaHCO3 2mol,所以当加入的NaHCO3 2mol时,即使Na2O2过量(多于2mol),产生气体只有2mol,错误。
Na2CO3+ CO2+ H2O,需NaHCO3 2mol,所以当加入的NaHCO3 2mol时,即使Na2O2过量(多于2mol),产生气体只有2mol,错误。
考点:考查NaHCO3、Na2O2的化学性质、物质的量的计算。

练习册系列答案
相关题目
足量的铜与一定量的浓硝酸反应得到硝酸铜溶液和NO、N2O4、NO2的混合气体,这些气体与1.68升O2(标准状况)混合后通入水中,所有气体完全被水吸收生成硝酸。则和铜反应的硝酸的物质的量可能是( )
| A.0.4mol | B.0.55mol | C.0.6mol | D.0.65mol |
将7.8g Na2O2和2.7g Al同时放入一定量的水中,充分反应后得到100mL溶液,再向该溶液中缓慢通入HCl气体3.36L(标准状况),若忽略反应过程中溶液的体积变化,则下列判断正确的是
| A.反应过程中得到3.36L(标准状况)的气体 |
| B.反应结束得到3.9g的沉淀 |
| C.反应结束得到的溶液中c(Na+)= c(Cl-)+ c(OH-) |
| D.反应结束得到的溶液中c(NaCl)="1.0" mol·L-1 |
设NA表示阿伏加德罗常数的值,下列说法正确的是
| A.4.0 g重水(D2O)中所含中子数为1.6 NA |
| B.1 L 2 mol·L-1 K2S溶液中S2-和HS-的总数为2 NA |
| C.2.4g金刚石与石墨的混合物中所含碳原子数为0.2 NA |
| D.50 mL 18 mol·L-1浓硫酸与足量铜反应,转移的电子数为0.9 NA |
设NA为阿伏加德罗常数的数值,下列说法中正确的是
| A.电解精炼粗铜时,每转移NA个电子,阳极溶解32g铜 |
| B.1L0.1mo1·L-1的氨水中含OH-离子数为0.lNA个 |
| C.常温常压下,a mo1O2与2a mo1NO混合,降温得到混合气体中氧原子数小于4aNA |
D.在反应5NH4NO3 2HNO3+4N2↑+9H2O中,每生成4molN2,转移电子数为15NA 2HNO3+4N2↑+9H2O中,每生成4molN2,转移电子数为15NA |
用NA表示阿伏加德罗常数的值,下列叙述正确的是
| A.常温常压下,60g甲醛、乙酸与葡萄糖混合物充分燃烧消耗氧气分子数为2NA |
| B.常温常压下,22.4L氯气与足量镁粉充分反应,转移电子数为2NA |
| C.标准状况下,11.2LCCl4含有的分子数目为0.5NA |
| D.标准状况下,22.4L氦气所含原子数为2NA |
NA代表阿伏加德罗常数,下列叙述正确的是
| A.1 mol Cl2溶于水的过程中有2NA个电子转移 |
| B.在1 L 0.1 mol·L-1氟化钠溶液中含有F-数目为NA |
| C.1 mol甲醇中含有C—H键的数目为3NA |
| D.10 L pH=1的硫酸溶液中含有的H+数目为2NA |
下列有关化学用语正确的是
A.Na2S的电子式: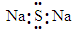 |
| B.铯—137:137Cs |
C.O2―的结构示意图: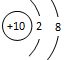 |
D.乙烯分子的球棍模型: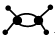 |
若NA为阿伏加德罗常数的值,下列叙述正确的是
| A.1 mol-OH中含有的质子数为9NA |
| B.lmol2,3—丁二醇分子中含C一C数目为4NA |
| C.1 L 1 mol.L-1FeCl3溶液中含有 Fe3 +数为NA |
| D.71 g氯气参与反应,电子转移数目一定为2NA |