题目内容
将7.8g Na2O2和2.7g Al同时放入一定量的水中,充分反应后得到100mL溶液,再向该溶液中缓慢通入HCl气体3.36L(标准状况),若忽略反应过程中溶液的体积变化,则下列判断正确的是
| A.反应过程中得到3.36L(标准状况)的气体 |
| B.反应结束得到3.9g的沉淀 |
| C.反应结束得到的溶液中c(Na+)= c(Cl-)+ c(OH-) |
| D.反应结束得到的溶液中c(NaCl)="1.0" mol·L-1 |
B
解析试题分析:0.1molNa2O2溶于水反应生成0.2molNaOH,放出0.05molO2,0.1molAl消耗NaOH0.1mol,放出0.15molH2,通入0.15molHCl ,和NaOH反应消耗0.1mol,剩余0.05mol和0.05molNaAlO2反应生成0.05molAl(OH)3沉淀,A、放出气体共0.2mol,标况下4.48L,错误;B、0.05molAl(OH)3是3.9克,正确;C、溶液中还剩余有0.05molNaAlO2,错误;D、反应结束得到的溶液中c(NaCl)= 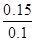 =1.5mol/L,错误。
=1.5mol/L,错误。
考点:考查元素化合物的性质、物质的量的计算

练习册系列答案
 开心蛙状元测试卷系列答案
开心蛙状元测试卷系列答案
相关题目
11.9g金属锡(Sn)跟100mL12mol·L-1HNO3共热一段时间。完全反应后测定溶液中c(H+)为8mol·L-1,溶液体积仍为100mL。产生的气体全部被氢氧化钠溶液吸收,消耗氢氧化钠0.4mol。由此推断氧化产物可能是
| A.SnO2·4H2O | B.Sn(NO3)4 |
| C.Sn(NO3)2 | D.Sn(NO3)2和Sn(NO3)4 |
设NA表示阿伏加德罗常数的数值,下列说法正确的是
| A.1 mol NaHCO3固体中含有NA个CO32- |
| B.1 mol CH3C1中所含的共价键数为4NA |
| C.常温下,稀释一定浓度的CH3COOH溶液,溶液的pH增大,CH3COOH的电离常数减小 |
| D.欲配制0.1mol ?L-1的CuSO4溶液,只需将25. 0 gCuSO4·5H2O溶于1 L水中即可 |
下列化学用语正确的是 ( )
| A.HCN分子的结构式:H-C≡N |
| B.乙烯的结构简式:CH2CH2 |
C.F-离子结构示意图: |
D.二氧化碳的电子式: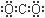 |
设N0表示阿伏加德罗常数的值。下列说法正确的是
| A.标准状况下,0.1 mol Cl2被氢氧化钠溶液完全吸收,转移的电子数目为0.2N0 |
| B.常温常压下,16 g CH4中含有的原子总数为5N0 |
| C.标准状况下,11.2 LCH3OH中含有的氢原子数目为2N0 |
| D.常温常压下,2.24 L CO和CO2混合气体中含有的碳原子数目为0.1N0 |
用NA表示阿佛加德罗常数的值。下列叙述正确的是 ( )
| A.在0 ℃时,22.4 L氢气中含有2NA个氢原子 |
| B.电解食盐水若产生2g氢气,则转移的电子数目为NA |
| C.1mol乙烷分子中共价键总数为7NA |
| D.密闭容器中46gNO2含有的分子数为NA |
下列有关化学用语表示正确的是
A.Be原子的结构示意图: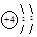 |
B.乙酸的结构简式: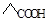 |
C.中子数为16的硫原子: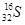 |
D.NH4Cl的电子式: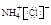 |
将amol小苏打和bmol过氧化钠置于某体积可变的密闭容器中充分加热,反应后测得容器内的氧气为1 mol,下列说法一定正确的是
| A.b="2" |
| B.反应中转移的电子数一定为2NA |
| C.容器中一定没有残余的CO2和水蒸气 |
| D.a:b≥1 |
设nA为阿伏加德罗常数的数值,下列说法正确的是
| A.标准状况下,11.2L的H2O中含有的原子数为1.5nA |
| B.0.1mol·L-1 的(NH4)2SO4溶液中,所含NH4+数小于0.2nA |
| C.常温常压下,16g的O2和O3混合气体中,含有的电子数为8 nA |
| D.质量相同的N2和CO中,含有的原子数均为2nA |