题目内容
NA代表阿伏加德罗常数,下列叙述正确的是
| A.1 mol Cl2溶于水的过程中有2NA个电子转移 |
| B.在1 L 0.1 mol·L-1氟化钠溶液中含有F-数目为NA |
| C.1 mol甲醇中含有C—H键的数目为3NA |
| D.10 L pH=1的硫酸溶液中含有的H+数目为2NA |
C
解析试题分析:氯气与水反应生成次氯酸和氯化氢,氯元素由0价变为—1价和+1价,氯气既是氧化剂又是还原剂,则Cl2+H2O HClO+HCl~e—,由于可逆反应不能进行到底,氯气与转移电子的系数之比等于物质的量之比,则1mol氯气溶于水转移电子小于1mol,故A选项错误;由于c?V=n,则NaF为0.1mol,由于氟化钠是强碱弱酸盐,氟离子能水解,则溶液中氟离子小于0.1mol,故B选项错误;甲醇的结构简式为CH3OH,则1mol甲醇分子中含有3molC—H键,故C选项正确;由于pH=—lgc(H+)=1,则c(H+)=0.1mol/L,由于c?V=n,则氢离子为1mol,故D选项错误。
HClO+HCl~e—,由于可逆反应不能进行到底,氯气与转移电子的系数之比等于物质的量之比,则1mol氯气溶于水转移电子小于1mol,故A选项错误;由于c?V=n,则NaF为0.1mol,由于氟化钠是强碱弱酸盐,氟离子能水解,则溶液中氟离子小于0.1mol,故B选项错误;甲醇的结构简式为CH3OH,则1mol甲醇分子中含有3molC—H键,故C选项正确;由于pH=—lgc(H+)=1,则c(H+)=0.1mol/L,由于c?V=n,则氢离子为1mol,故D选项错误。
考点:考查阿伏加德罗常数,涉及体积、气体摩尔体积、物质的量、氧化还原反应、物质的量在化学或电离方程式计算中的应用、物质的量浓度、强电解质、物质的组成、水的离子积、溶液的pH、电离方程式等。

练习册系列答案
相关题目
设NA表示阿伏加德罗常数的数值,下列说法正确的是
| A.1 mol NaHCO3固体中含有NA个CO32- |
| B.1 mol CH3C1中所含的共价键数为4NA |
| C.常温下,稀释一定浓度的CH3COOH溶液,溶液的pH增大,CH3COOH的电离常数减小 |
| D.欲配制0.1mol ?L-1的CuSO4溶液,只需将25. 0 gCuSO4·5H2O溶于1 L水中即可 |
下列有关化学用语表示正确的是
A.Be原子的结构示意图: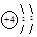 |
B.乙酸的结构简式: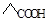 |
C.中子数为16的硫原子: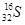 |
D.NH4Cl的电子式: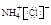 |
将amol小苏打和bmol过氧化钠置于某体积可变的密闭容器中充分加热,反应后测得容器内的氧气为1 mol,下列说法一定正确的是
| A.b="2" |
| B.反应中转移的电子数一定为2NA |
| C.容器中一定没有残余的CO2和水蒸气 |
| D.a:b≥1 |
设NA为阿伏加德罗常数的值。下列叙述正确的是
| A.标准状况下,2.24 L水中所含电子总数为NA |
| B.1 L 0.2 mol·L-1硫酸铁溶液中含有的SO42-数为0.2NA |
| C.苯和苯甲酸混合物1 mol,完全燃烧消耗O2的分子数为7.5NA |
| D.标准状况下,7.1 g氯气与足量石灰乳充分反应转移电子数为0.2NA |
设NA为阿伏加德罗常数,下列说法正确的是
| A.标准状况下,5.6 L四氯化碳含有的分子数为0.25NA |
| B.1 mol硫酸钾中阴离子所带电荷数为NA |
| C.标准状况下,22.4 L氯气与足量氢氧化钠溶液反应转移的电子数为NA |
| D.常温下,0.1mol/L的NH4NO3溶液中氮原子数为0.2NA |
设阿伏加德罗常数(NA)的数值为nA,下列说法正确的是(相对原子质量:H-1、O-16)
| A.11.2LNH3所含分子数为0.5nA |
| B.1molCl2与足量Fe反应,转移的电子数为3nA |
| C.100mL1mol/LFeCl3溶液中含Fe3+微粒的数目是0.1nA |
| D.常温下,34gH2O2中H-O键数目为2nA |
设nA为阿伏加德罗常数的数值,下列说法正确的是
| A.标准状况下,11.2L的H2O中含有的原子数为1.5nA |
| B.0.1mol·L-1 的(NH4)2SO4溶液中,所含NH4+数小于0.2nA |
| C.常温常压下,16g的O2和O3混合气体中,含有的电子数为8 nA |
| D.质量相同的N2和CO中,含有的原子数均为2nA |
用1molMnO2和含HCl为4mol的浓盐酸充分反应(共热),在不考虑HCl挥发的情况下,得到的氯气的物质的量
| A.等于2mol | B.等于1mol | C.小于1 mol | D.大于2 mol |