题目内容
16.配平化学方程式:5KI+1KIO3+3H2SO4═3K2SO4+3I2+3H2O.分析 碘元素由碘化钾中的-1价升高到0价,碘酸钾中的碘元素化合价由+5价降为0价,氧化还原反应中化合价升降数目相等,结合原子个数守恒配平方程式.
解答 解:反应中碘元素由碘化钾中的-1价升高到0价,碘酸钾中的碘元素化合价由+5价降为0价,氧化还原反应中化合价升降数目相等,碘化钾系数为5,碘酸钾系数为1,生成单质碘3mol,依据原子个数守恒可知硫酸钾系数6,硫酸系数3,水系数为3,
故答案为:5;1;3;3;3;3.
点评 本题考查了氧化还原方程式的配平,准确判断元素化合价升降依据氧化还原反应化合价升降数目相等即可解答,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
6.现有部分短周期元素的性质或原子结构如下表:
(1)写出元素X的离子结构示意图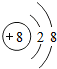 .写出元素Z的单质的电子式
.写出元素Z的单质的电子式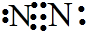 (用元素符号表示)
(用元素符号表示)
(2)写出Y元素的硫酸盐溶于水的电离方程式Al2(SO4)3═2Al3++3SO42-;
(3)元素T在周期表中的位置是第二周期ⅤⅡA族;下列表述能比较T与氯元素非金属性强弱的事实是cd
a.常温下氯气的颜色比T单质的颜色深
b.T的单质通入氯化钠水溶液不能置换出氯气
c.氯与T形成的化合物中氯元素呈正价态
d.T的气态氢化物比氯化氢稳定.
| 元素编号 | 元素性质或原子结构 |
| T | 单质能与水剧烈反应,所得溶液呈弱酸性 |
| X | 原子最外层电子数是次外层的3倍 |
| Y | 第三周期元素的简单离子中半径最小 |
| Z | 气态氢化物与最高氧化物对应水化物可发生化合反应 |
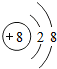 .写出元素Z的单质的电子式
.写出元素Z的单质的电子式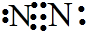 (用元素符号表示)
(用元素符号表示)(2)写出Y元素的硫酸盐溶于水的电离方程式Al2(SO4)3═2Al3++3SO42-;
(3)元素T在周期表中的位置是第二周期ⅤⅡA族;下列表述能比较T与氯元素非金属性强弱的事实是cd
a.常温下氯气的颜色比T单质的颜色深
b.T的单质通入氯化钠水溶液不能置换出氯气
c.氯与T形成的化合物中氯元素呈正价态
d.T的气态氢化物比氯化氢稳定.
7.下列物质的电子式错误的是( )
| A. | CaCl2 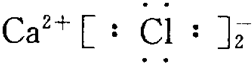 | |
| B. | Na2O  | |
| C. | NaCl 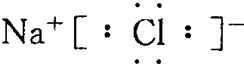 | |
| D. | H2O  |
4.短周期元素W、X、Y、Z的原子序数依次增大,其中W的阴离子的核外电子数与X、Y、Z原子的核外内层电子数相同.X的一种核素在考古时常用来鉴定一些文物的年代,工业上采用液态空气分馏方法来生产Y的单质,而Z不能形成双原子分子,根据以上叙述,下列说法正确的是( )
| A. | 上述四种元素的原子半径大小为W<X<Y<Z | |
| B. | W、X、Y、Z原子的核外最外层电子数的总和为20 | |
| C. | W与Y可形成既含极性共价键又含有非极性共价键的化合物 | |
| D. | XW4一定高于YW3的稳定性 |
8.碳化硅的晶体有类似金刚石的结构,其中碳原子和硅原子的位置是交替的.它与晶体硅和金刚石相比较,正确的是( )
| A. | 熔点从高到低的顺序是:金刚石>碳化硅>晶体硅 | |
| B. | 熔点从高到低的顺序是:金刚石>晶体硅>碳化硅 | |
| C. | 三种晶体中的结构单元都是三角锥结构 | |
| D. | 三种晶体都是原子晶体且均为电的良导体 |
6.如图所示图象,不能正确反映其对应变化关系的是( )
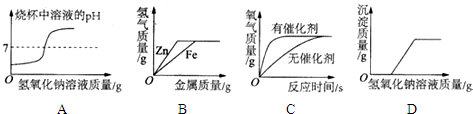

| A. | 向盐酸中逐渐滴加氢氧化钠溶液 | |
| B. | 向等质量、等浓度的稀硫酸中分别逐渐加入锌粉和铁粉 | |
| C. | 用等质量、等浓度的过氧化氢溶液在有无催化剂条件下制氧气 | |
| D. | 向一定质量氯化铜和稀盐酸的混合溶液中逐滴加入氢氧化钠溶液 |
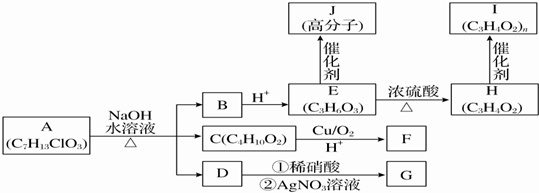
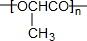 .
.