题目内容
6.如图所示图象,不能正确反映其对应变化关系的是( )
| A. | 向盐酸中逐渐滴加氢氧化钠溶液 | |
| B. | 向等质量、等浓度的稀硫酸中分别逐渐加入锌粉和铁粉 | |
| C. | 用等质量、等浓度的过氧化氢溶液在有无催化剂条件下制氧气 | |
| D. | 向一定质量氯化铜和稀盐酸的混合溶液中逐滴加入氢氧化钠溶液 |
分析 A.酸碱中和过程中,向盐酸中逐渐滴加氢氧化钠溶液,溶液pH变大,滴定终点pH发生突变;
B.金属越活泼,和酸反应的速率越快,金属的相对原子质量越小,产生的氢气越多;
C.等质量、等浓度的双氧水分别制取氧气,有无催化剂只是改变化学反应的速率,不影响生成氧气的量;
D.混合溶液加入过量氢氧化钠溶液,氢氧化钠先和盐酸反应,等到盐酸反应完毕后,氢氧化钠再和氯化铜反应生成氢氧化铜沉淀,所以一开始没有沉淀,随后生成醇,全部沉淀后测得量不再变化.
解答 解:A.向盐酸中滴加氢氧化钠溶液,发生中和反应,溶液的pH变大,当氢氧化钠过量时,溶液显碱性,故A正确;
B.锌比铁活泼,与稀硫酸反应时,锌比铁反应剧烈;当等质量、等浓度的稀硫酸中分别逐渐加入锌粉和铁粉时,金属有剩余,酸不足,故产生氢气相等;等质量的金属,铁生成的氢气比锌多,故B错误;
C.用等质量、等浓度的双氧水分别制取氧气,有无催化剂只是改变化学反应的速率,不影响生成氧气的量,所以最终生成氧气的质量应该相等,故C正确;
D.氯化铜和盐酸的混合溶液加入过量氢氧化钠溶液,氢氧化钠先和盐酸反应,等到盐酸反应完毕后,氢氧化钠再和氯化铜反应生成氢氧化铜沉淀,所以一开始没有沉淀,等到盐酸反应完后有沉淀生成,氯化铜反应完后沉淀不再增加,为一定值,故D正确.
故选B.
点评 本题是化学反应与图象知识的考查,结合反应的过程与图象情况的走势联系起来是解题的关键所在,注意起点、拐点、终点、变化趋势等分析方法,掌握基础是关键,题目难度中等.

练习册系列答案
 欣语文化快乐暑假沈阳出版社系列答案
欣语文化快乐暑假沈阳出版社系列答案
相关题目
14.用NA表示阿伏加德罗常数的值.下列叙述正确的是( )
| A. | 在H2O2+Cl2═2HCl+O2反应中,每生成32 g氧气,则转移4NA个电子 | |
| B. | 17.4 g某硫化磷(如图)中含P-S键数目为0.6NA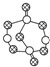 | |
| C. | 1 mol含8个碳原子的某烃分子,最多形成7 mol碳碳单键 | |
| D. | 标准状况下,22.4 L SO2与O2混合气体,含有2NA个氧原子 |
1.设NA为阿伏加德罗常数的值,下列说法不正确的是( )
| A. | 46 g C2H6O中含有的C-H键数一定为5NA | |
| B. | 常温常压下,17 g甲基(-14CH3)所含电子总数为9NA | |
| C. | 标准状况下,11.2 L CO2和乙炔的混合气体所含π键数目为NA | |
| D. | CO2气体与足量的Na2O2反应,固体增重28 g时转移了NA个电子 |
11.几种短周期元素的原子半径及某些化合价见下表.分析判断下列说法正确的是( )
| 元素代号 | A | B | D | E | G | H | I | J |
| 化合价 | -1 | -2 | +4、-4 | -1 | +5、-3 | +3 | +2 | +1 |
| 原子半径/nm | 0.071 | 0.074 | 0.077 | 0.099 | 0.110 | 0.143 | 0.160 | 0.186 |
| A. | A的单质能将E单质从HE的溶液中置换出来 | |
| B. | A、H、J的离子半径由大到小顺序是A>J>H | |
| C. | G元素的单质不存在同素异形体 | |
| D. | I在DB2中燃烧生成两种化合物 |
18.柑橘是人们在日常生活中喜爱的水果之一,从柑橘中可提炼出有机物萜二烯,其结构简式为 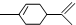 ,下列有关萜二烯的推测不正确的是( )
,下列有关萜二烯的推测不正确的是( )
 ,下列有关萜二烯的推测不正确的是( )
,下列有关萜二烯的推测不正确的是( )| A. | 萜二烯属于芳香烃 | B. | 萜二烯难溶于水 | ||
| C. | 萜二烯能发生加聚反应 | D. | 萜二烯能使酸性高锰酸钾溶液褪色 |
15.下列说法中正确的是( )
| A. | NaHSO4熔化时,离子键和共价键均被破坏 | |
| B. | 过氧化氢中只有非极性共价键 | |
| C. | 金属元素与非金属元素化合时,一定形成离子键 | |
| D. | 非金属元素也可能形成离子键 |
16.下列关于氯元素的说法正确的是( )
| A. | HCl具有很强的酸性,所以氯元素的非金属性很强 | |
| B. | ${\;}_{17}^{35}$Cl、${\;}_{17}^{37}$Cl为不同的核素,有不同的化学性质 | |
| C. | 1.12LCl2含有1.7NA个质子(NA 表示阿伏加德罗常数) | |
| D. | 氯气可从KI溶液中置换出I2,说明氯的非金属性比碘强 |
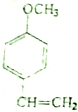 最多能与4mol的氢气发生加成反应;与溴水反应生成物的结构简式为
最多能与4mol的氢气发生加成反应;与溴水反应生成物的结构简式为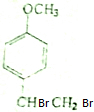 .
.