题目内容
16.A、B、C三种有机物,实验式均为CH2O,其中A的相对分子质量为H2的15倍,常温下为气体,A的名称为甲醛.B、C蒸汽密度与同温同压下丙醇蒸汽密度相同,且B能与金属钠反应而C不能,则B的名称是2-丙醇,结构简式为CH3CH(OH)CH3,C的结构简式为CH3CH2OCH3.分析 依据“A的相对分子质量为H2的15倍”得出A的相对分子质量为30,实验式为CH2O,据此得出A为甲醛;
B、C蒸汽密度与同温同压下丙醇蒸汽密度相同,丙醇的相对分子质量为60,据此解答即可.
解答 解:“A的相对分子质量为H2的15倍”得出A的相对分子质量为30,实验式为CH2O,据此得出A为甲醛;
B、C蒸汽密度与同温同压下丙醇蒸汽密度相同,丙醇的相对分子质量为:60,B能与金属钠反应,则B为醇类,与丙醇互为同分异构体,那么B应为2-丙醇,结构简式为:CH3CH(OH)CH3,C不能与金属钠反应,那么C应为醚类,结构简式为:CH3CH2OCH3,
故答案为:甲醛;2-丙醇;CH3CH(OH)CH3;CH3CH2OCH3.
点评 本题主要考查的是有机物的推断,涉及醇类的性质,有机物官能团的判断等,综合性较强,难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
7.能在水溶液中大量共存的一组离子是( )
| A. | H+、Al3+、NO3-、SiO32- | B. | Ca2+、Fe3+、Cl-、CO32- | ||
| C. | Na+、SO42-、OH-、NO3- | D. | NH4+、OH-、Cl-、HSO3- |
4.下列各对化合物中,化学键类型都相同的一组是( )
| A. | CCl4、KCl | B. | NaCl、HF | C. | MgCl2、NH4Cl | D. | H2S、AlCl3 |
1.25℃时某气态烃与O2混合充入密闭容器中,点燃后又恢复至25℃,此时容器内压强为原来的$\frac{1}{3}$,再经NaOH溶液处理,容器内几乎成为真空,该烃的化学时为( )
| A. | CH4 | B. | C2H6 | C. | C3H8 | D. | C4H10 |
8.某烯烃加氢后生成物的结构简式为 ,符合这一条件的烯烃有( )
,符合这一条件的烯烃有( )
 ,符合这一条件的烯烃有( )
,符合这一条件的烯烃有( )| A. | 1种 | B. | 2种 | C. | 3种 | D. | 4种 |
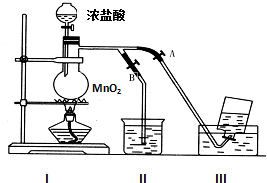 如图表示在没有通风橱收集纯净的氯气时设计的装置,图中A、B是可控制的弹簧铁夹.
如图表示在没有通风橱收集纯净的氯气时设计的装置,图中A、B是可控制的弹簧铁夹.


 按以下步骤从
按以下步骤从 合成
合成  .(部分试剂和反应条件已略去)
.(部分试剂和反应条件已略去) 、D
、D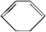 .
.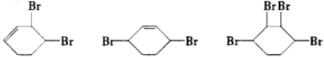 ;
; $→_{△}^{浓硫酸}$
$→_{△}^{浓硫酸}$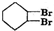 +2NaOH$→_{△}^{醇}$
+2NaOH$→_{△}^{醇}$