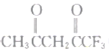题目内容
【题目】一氧化二氮俗称笑气,是一种氧化剂,也可以用来作为火箭和赛车的氧化剂。值得注意的是,N2O是一种强大的温室气体,它的效果是二氧化碳的296倍,因此研究其分解对环境保护有着重要意义。
(1)一氧化二氮早期被用于牙科手术的麻醉,它可由硝酸铵在催化剂下分解制得,该反应的化学方程式为______________。
(2)已知反应2N2O(g)![]() 2N2(g)+O2(g)的ΔH=-163kJ/mol, 1mol N2(g)、1mol O2(g) 分子中化学键断裂时分别需要吸收945kJ、498kJ 的能量,则1mol N2O(g)分子中化学键断裂时需要吸收的能量为_________________________________________ kJ。
2N2(g)+O2(g)的ΔH=-163kJ/mol, 1mol N2(g)、1mol O2(g) 分子中化学键断裂时分别需要吸收945kJ、498kJ 的能量,则1mol N2O(g)分子中化学键断裂时需要吸收的能量为_________________________________________ kJ。
(3)碘蒸气存在能大幅度提高2N2O(g)![]() 2N2(g)+O2(g)的分解速率,反应历程为:
2N2(g)+O2(g)的分解速率,反应历程为:
第一步I2(g)![]() 2I(g)(快反应)
2I(g)(快反应)
第二步________________________(慢反应)
第三步IO(g)+N2O(g)![]() N2(g)+O2(g)+I(g)(快反应)
N2(g)+O2(g)+I(g)(快反应)
第二步反应方程式为__________________________________,活化能最大的是第____步反应。
(4)T℃下将N2O充入5L的刚性容器中,发生反应2N2O(g)![]() 2N2(g)+O2(g)的部分实验数据如图:
2N2(g)+O2(g)的部分实验数据如图:
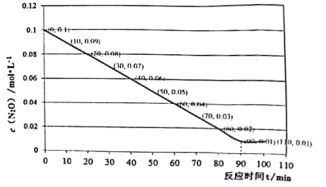
①T℃该反应的平衡常数值为________________,100min 时,向容器中加入0.1mol N2O和0.9mol N2,此时平衡________________(填“向正反应方向移动、向逆反应方向移动、不移动”)。
②半衰期是指任一浓度N2O消耗一半时所需的相应时间。N2O从某一浓度到另一浓度需要时间t可表示为![]() 其中kp为速率常数,p、p0均为N2O的分压。1030K下,在一刚性容器中充入N2O气体发生分解反应,当初始压力为a kPa,半衰期时容器总压强为___________,当容器内总压强到达b kPa时,反应所需的时间为___________。 (用代数式表示,不用化简) [已知:1030K时,kp=9.8×105(kPa·s-1)]
其中kp为速率常数,p、p0均为N2O的分压。1030K下,在一刚性容器中充入N2O气体发生分解反应,当初始压力为a kPa,半衰期时容器总压强为___________,当容器内总压强到达b kPa时,反应所需的时间为___________。 (用代数式表示,不用化简) [已知:1030K时,kp=9.8×105(kPa·s-1)]
【答案】NH4NO3 N2O+2H2O 1112.5 N2O(g)+I(g)→N2(g)+IO(g) 二 3.645 不移动 1.25kPa
N2O+2H2O 1112.5 N2O(g)+I(g)→N2(g)+IO(g) 二 3.645 不移动 1.25kPa 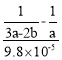 s
s
【解析】
(1)硝酸铵在催化剂下分解得一氧化二氮和水,则化学方程式为NH4NO3 N2O+2H2O;
N2O+2H2O;
(2)△H=反应物键能总和-生成物键能总和;设1molN2O(g)分子中化学键断裂时需要吸收的能量为x kJ,则-163=2x-2×945-498,解得x=1112.5;
(3)根据题意可知碘蒸气为催化剂,所以第二步+第三步得到2N2O(g)2N2(g)+O2(g),则第二步方程式为N2O(g)+I(g)N2(g)+IO(g);活化能越大,反应速率越慢,第二步为慢反应则其活化能最大;
(4)①据图可知起始物质只有N2O,且浓度为0.1mol/L,90分钟后达到平衡,此时c(N2O)=0.01mol/L,根据方程式2N2O(g)![]() 2N2(g)+O2(g)可知生成的c(N2)=0.09mol/L,c(O2)=0.045mol/L,则平衡常数K=
2N2(g)+O2(g)可知生成的c(N2)=0.09mol/L,c(O2)=0.045mol/L,则平衡常数K=![]() =3.645;向容器中加入0.1molN2O和0.9molN2后,N2O、N2、O2浓度依次为0.03mol/L、0.27mol/L、0.045mol/L,Qc=
=3.645;向容器中加入0.1molN2O和0.9molN2后,N2O、N2、O2浓度依次为0.03mol/L、0.27mol/L、0.045mol/L,Qc=![]() =3.645=K,则平衡不移动;
=3.645=K,则平衡不移动;
②反应起始物质只有N2O,浓度为0.1mol/L,初始压力为akPa,根据半衰期的含义即发生的反应方程式可知此时体系内N2O、N2、O2浓度依次为0.05mol/L、0.05mol/L、0.025mol/L,恒容容器中压强比等于气体物质的量之比,继而等于浓度之比,所以平衡时总压强为a kPa×![]() =1.25 kPa;设容器内总压强到达bkPa时,N2O的转化浓度为2x,则此时容器内c(N2O)=(0.1-2x)mol/L,c(N2)=2x mol/L,c(O2)=x mol/L,所以有
=1.25 kPa;设容器内总压强到达bkPa时,N2O的转化浓度为2x,则此时容器内c(N2O)=(0.1-2x)mol/L,c(N2)=2x mol/L,c(O2)=x mol/L,所以有![]() ,解得x=0.1×(
,解得x=0.1×(![]() -
-![]() )mol/L,此时p(N2O)=
)mol/L,此时p(N2O)=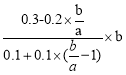 kPa=(3a-2b) kPa,所以
kPa=(3a-2b) kPa,所以![]() =
=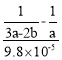 s。
s。