题目内容
【题目】实验室可用SiC与Cl2反应(SiC+2Cl2![]() SiCl4+C)制取少量SiCl4(沸点57.6℃,易水解)。下列实验原理和装置不能达到实验目的的是
SiCl4+C)制取少量SiCl4(沸点57.6℃,易水解)。下列实验原理和装置不能达到实验目的的是
A.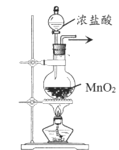 制取氯气
制取氯气
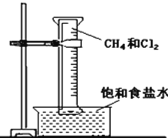
B.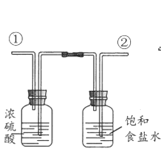 净化氯气,气体从接口①进入
净化氯气,气体从接口①进入
C.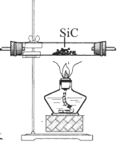 制取四氯化硅
制取四氯化硅
D.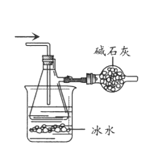 收集四氯化硅粗产品
收集四氯化硅粗产品
【答案】B
【解析】
A.实验室利用MnO2和浓盐酸加热制备Cl2,可以达到实验目的,A不选;
B.利用浓盐酸制备Cl2,含有H2O、HCl等杂质,利用饱和食盐水除去HCl,利用浓硫酸除去水,除杂时,应该先除去HCl,再除去水;除杂时,应该长导管进,选项中的装置不能达到实验目的,B选;
C.SiC和Cl2加热制备CCl4,可以达到实验目的,C不选;
D.SiCl4的沸点57.6℃,沸点较低,可以通过冷凝收集到SiCl4,由于SiCl4易水解,而且需要吸收过量的Cl2,因此需要接一个装有碱石灰的干燥管,可以防止空气中的水蒸气进入,也可以吸收多余的Cl2,可以达到实验目的,D不选。
答案选B。

练习册系列答案
相关题目