题目内容
【题目】碳及其化合物广泛存在于自然界中,回答下列问题:
(1)在基态C原子中,核外存在_______对自旋方向相反的电子。
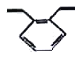
(2)丙酮(![]() )分子中,中间碳原子的杂化方式为______;
)分子中,中间碳原子的杂化方式为______;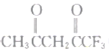 中
中![]() 键和π键的数目之比为__________________.
键和π键的数目之比为__________________.
(3)写出两个与CO2具有相同空间构型的分子或离子:_____________
(4)CO能与金属Fe形成Fe(CO)5,该化合物的熔点为253K,沸点为376K,其固体属于_____晶体;Fe3+的核外电子排布式为__________________。
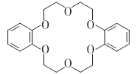
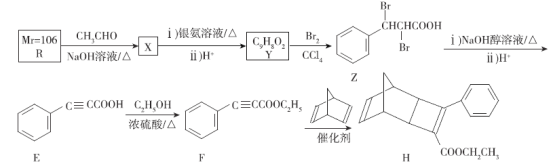
(5)已知第IIA族元素的碳酸盐MCO3热分解的主要过程为M2+结合碳酸根离子中的O2-,释放出CO2。则CaCO3的分解温度低于BaCO3的原因是_______________。分子中的大π键用符号![]() 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为
表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为![]() ),则CO32-中的大π键应表示为____________。
),则CO32-中的大π键应表示为____________。
(6)碳有多种同素异形体,其中石墨烯与金刚石的晶体结构如图所示:
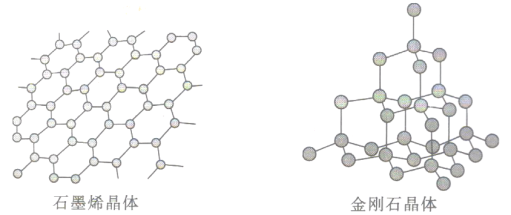
①在石墨烯晶体中,一个六元环上的C原子数为__________________。
②在金刚石晶体中,C原子所连接的最小环也为六元环,每个C原子连接_____个六元环,六元环中最多有_______个C原子在同一平面。
【答案】2 sp2 7:1 CS2、SCN-等 分子 1s22s22p63s23p63d5 Ca2+的半径小于Ba2+,更容易结合CO32-中O2-,因此CaCO3更容易分解 ![]() 2 12 4
2 12 4
【解析】
(1)C原子的核外有6个电子,电子排布式为1s22s2p2,其中1s、2s上的2对电子的自旋方向相反,而2p轨道上的电子自旋方向相同,所以核外存在2对自旋方向相反的电子;
(2)丙酮分子中中间碳原子形成碳氧双键,为sp2杂化;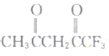 分子中每个碳氧双键中各有一个π键,其他化学键均为
分子中每个碳氧双键中各有一个π键,其他化学键均为![]() 键,共14个,所以
键,共14个,所以![]() 键和π键的数目之比为7:1;
键和π键的数目之比为7:1;
(3)O与S同主族,所以与CO2具有相同空间结构的分子为CS2;等电子体具有相同的空间结构,与CO2互为等电子的离子有SCN-;
(4)Fe(CO)5的熔点为253K,沸点为376K,熔沸点较低,所以为分子晶体;Fe为26号元素,根据电子排布规律可知基态Fe原子核外电子排布为1s22s22p63s23p63d64s2,失去外层3个电子后形成Fe3+,所以其核外电子排布为1s22s22p63s23p63d5;
(5)Ca2+的半径小于Ba2+,更容易结合CO32-中O2-,因此CaCO3更容易分解;CO32-中心原子价层电子对数为![]() ,因此CO32-的空间构型为平面三角形,C原子、O原子有平行的p轨道,价电子总数为4+2+6×3=24,每个O原子有2对孤电子对未参与成键,所以单电子数=24-2×3-4×3=6,所以CO32-为4原子、6电子形成的大π键,表示为
,因此CO32-的空间构型为平面三角形,C原子、O原子有平行的p轨道,价电子总数为4+2+6×3=24,每个O原子有2对孤电子对未参与成键,所以单电子数=24-2×3-4×3=6,所以CO32-为4原子、6电子形成的大π键,表示为![]() ;
;
(6)①根据均摊法,石墨烯中每个C原子被3个六元环共有,则每个六元环占有的C原子数为![]() =2;
=2;
②每个C原子周围形成4个共价键,可以组合6个角,每个角延伸为两个六元环,因此每个C原子连接有2×6= 12个六元环;根据几何知识,六元环中最多有4个C原子共面,如图所示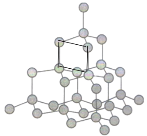 。
。