题目内容
【题目】甲烷、乙烯、环氧乙烷、丁烷都是重要的化工原料,用途广泛,回答下列问题:
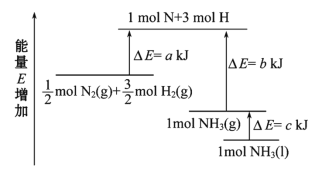
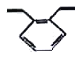
已知:Ⅰ.2CH2=CH2(g)+O2(g)2![]() (g) ΔH1<0
(g) ΔH1<0
Ⅱ.CH2=CH2(g)+3O2(g)2CO2(g)+2H2O(l) ΔH2
Ⅲ.2![]() (g) +5O2(g) 4CO2(g)+4H2O(l) ΔH3
(g) +5O2(g) 4CO2(g)+4H2O(l) ΔH3
(1)若反应Ⅲ是在一定温度下可自发进行,则ΔH3______(填“>”“<”或“=”)0。
(2)热值是表示单位质量的燃料完全燃烧时所放出的热量,是燃料质量的一种重要指标。已知乙烯的热值为50.4kJ·g-1,则△H2=________kJ·mol-1。
(3)实验测得2CH2=CH2(g)+O2(g)2![]() (g) ΔH1<0中,v正=k正·c2(CH2=CH2)·c(O2),v逆=k逆·c2(
(g) ΔH1<0中,v正=k正·c2(CH2=CH2)·c(O2),v逆=k逆·c2(![]() )(k正、k逆为速率常数,只与温度有关)。
)(k正、k逆为速率常数,只与温度有关)。
①达到平衡后,仅升高温度,k正增大的倍数________(填“大于”“小于”或“等于”) k逆增大的倍数。
②若在1L的密闭容器中充入1mol CH2=CH2(g)和1mol O2(g),在一定温度下只发生反应Ⅰ,经过10min 反应达到平衡,CH2=CH2(g)的转化率为40%,则0~10min内,v(O2)=_________,![]() =___________(保留两位有效数字)。
=___________(保留两位有效数字)。
(4)下列有关环氧乙烷制备的说法正确的是________(填字母)。
A.由图1可知,进料气体的初始温度对环氧乙烷的选择性影响不大,可得出乙烯的转化率受初始温度的影响不大
B.由图2可知,原料气的流速加快,乙烯转化率下降,主要是原料气与催化剂接触时间过短造成
C.若进料气中氧气比例增大,环氧乙烷产率降低,其主要原因是部分乙烯、环氧乙烷转化为二氧化碳和水
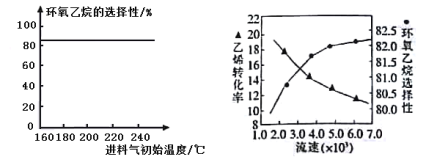
图1环氧乙烷选择性与进料气体初始温度关系 图2乙烯转化率-环氧乙烷选择性与进料气体流速关系
(5)一种以天然气为物燃料的固体氧化物燃料电池的原理如图所示,其中YSZ为6%~10%Y2O3掺杂的ZrO2固体电解质。
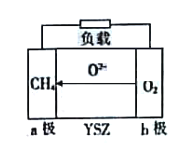
a极上的电极反应式为_____________;若电路中转移0.1mol电子,则消耗标准状况下CH4的体积为_____________ L。
【答案】< -1411.2 小于 0.02mol/(Lmin) 0.56 BC CH4-8e- +4O2- =CO2+2H2O 0.28
【解析】
(1)反应Ⅲ:2![]() (g) +5O2(g)4CO2(g)+4H2O(l)是体系混乱度减小的反应,根据ΔG=ΔH-TΔS<0分析判断;
(g) +5O2(g)4CO2(g)+4H2O(l)是体系混乱度减小的反应,根据ΔG=ΔH-TΔS<0分析判断;
(2)结合热值计算乙烯的燃烧热,根据盖斯定律,将![]() ×(Ⅰ+Ⅲ)整理可得;
×(Ⅰ+Ⅲ)整理可得;
(3)①反应2CH2=CH2(g)+O2(g)2![]() (g)ΔH1<0的正反应是放热反应,在其他条件不变时,升高温度,v正、v逆都增大,由于温度对吸热反应影响更大,结合v正=k正·c2(CH2=CH2)·c(O2),v逆=k逆·c2(
(g)ΔH1<0的正反应是放热反应,在其他条件不变时,升高温度,v正、v逆都增大,由于温度对吸热反应影响更大,结合v正=k正·c2(CH2=CH2)·c(O2),v逆=k逆·c2(![]() )分析判断;
)分析判断;
②达到平衡时乙烯的转化率为40%,则参与反应的乙烯的物质的量为1mol×40%=0.4mol,根据反应计算氧气的物质的量进而计算v(O2);反应达到平衡时,计算化学平衡常数K;由于反应达到平衡时,v正=v逆,所以k正·c2(CH2=CH2)·c(O2)= k逆·c2(![]() );
);
(4)A.根据图示可知,进料气体的初始温度对环氧乙烷的选择性影响不大,可能是温度对副反应的影响较小造成的,但不能得到初始温度对乙烯的转化率影响不大的结论;
B.流速越快,反应物接触时间越短,消耗乙烯的量越少;
C.若进料气中O2比例增大,环氧乙烷与氧发生副反应转化为氧化碳和水;
(5)根据图示可知在a电极通入甲烷为负极,失去电子发生氧化反应;根据电极反应计算CH4的物质的量,再利用V=nVm计算。
(1)反应Ⅲ:2![]() (g) +5O2(g)4CO2(g)+4H2O(l)是体系混乱度减小的反应,ΔS<0,若在一定温度下可自发进行,根据ΔG=ΔH-TΔS<0,ΔS<0则ΔH<0,即ΔH3<0;
(g) +5O2(g)4CO2(g)+4H2O(l)是体系混乱度减小的反应,ΔS<0,若在一定温度下可自发进行,根据ΔG=ΔH-TΔS<0,ΔS<0则ΔH<0,即ΔH3<0;
(2)热值是表示单位质量的燃料完全燃烧时所放出的热量,是燃料质量的一种重要指标。已知乙烯的热值为50.4kJ·g-1,则1mol乙烯的燃烧热为-50.4 kJ·g-1×28g/mol=-1411.2kJ·mol-1,根据盖斯定律,将![]() ×(Ⅰ+Ⅲ)整理可得,CH2=CH2(g)+3O2(g)2CO2(g)+2H2O(l) ΔH2=
×(Ⅰ+Ⅲ)整理可得,CH2=CH2(g)+3O2(g)2CO2(g)+2H2O(l) ΔH2=![]() ×(H1+ H3)= -1411.2kJ·mol-1;
×(H1+ H3)= -1411.2kJ·mol-1;
(3)①反应2CH2=CH2(g)+O2(g)2![]() (g)ΔH1<0的正反应是放热反应,在其他条件不变时,升高温度,v正、v逆都增大,由于温度对吸热反应影响更大,所以v逆增大的比v正最大的多,使得v正<v逆,所以化学平衡向逆向移动,v正=k正·c2(CH2=CH2)·c(O2),v逆=k逆·c2(
(g)ΔH1<0的正反应是放热反应,在其他条件不变时,升高温度,v正、v逆都增大,由于温度对吸热反应影响更大,所以v逆增大的比v正最大的多,使得v正<v逆,所以化学平衡向逆向移动,v正=k正·c2(CH2=CH2)·c(O2),v逆=k逆·c2(![]() ),因此达到平衡后,仅升高温度,k正增大的倍数小于k逆增大的倍数;
),因此达到平衡后,仅升高温度,k正增大的倍数小于k逆增大的倍数;
②根据方程式可知,乙烯与氧气反应的物质的量之比为span>2:1,由于开始时加入了1mol乙烯,达到平衡时乙烯的转化率为40%,则参与反应的乙烯的物质的量为1mol×40%=0.4mol,所以反应的氧气的物质的量为0.2mol,故0~10min内v(O2)=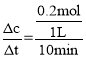 =0.02mol/(Lmin);反应达到平衡时c(CH2=CH2)=
=0.02mol/(Lmin);反应达到平衡时c(CH2=CH2)=![]() =0.6mol/L,c(O2)=
=0.6mol/L,c(O2)=![]() = 0.8mol/L,c(
= 0.8mol/L,c(![]() )=
)=![]() =0.4mol/L,化学平衡常数K=
=0.4mol/L,化学平衡常数K=![]() =
=![]() ;由于反应达到平衡时,v正=v逆,所以k正·c2(CH2=CH2)·c(O2)= k逆·c2(
;由于反应达到平衡时,v正=v逆,所以k正·c2(CH2=CH2)·c(O2)= k逆·c2(![]() ),故
),故![]() =
=![]() =K=
=K=![]() =0.56;
=0.56;
(4)A.根据图示可知,进料气体的初始温度对环氧乙烷的选择性影响不大,可能是温度对副反应的影响较小造成的,但不能得到初始温度对乙烯的转化率影响不大的结论,实际上升高温度,物质转化率相对有较大影响,故A错误;
B.流速越快,反应物与催化剂接触时间越短,消耗乙烯的量越少,导致乙烯转化率下降,故B正确;
C.若进料气中O2比例增大,环氧乙烷产率降低,其主要原因是环氧乙烷与氧发生副反应转化为氧化碳和水,故C正确;
故答案选BC;
(5)根据图示可知,该装置为燃料电池,通入燃料的一极为负极,在a电极通入甲烷为负极,失去电子发生氧化反应,电极反应式为CH4-8e- +4O2- =CO2+2H2O,每有1 molCH4发生反应,转移8 mol电子;若电路中转移0.1 mol电子,消耗CH4的物质的量为n(CH4)=![]() ×0.1 mol=0.0125 mol,其在标准状况下的体积V(CH4)=nVm=0.0125mol×22.4 L/mol=0.28 L。
×0.1 mol=0.0125 mol,其在标准状况下的体积V(CH4)=nVm=0.0125mol×22.4 L/mol=0.28 L。

【题目】为了探究化学反应速率和化学反应限度的有关问题,某研究小组进行了以下实验:
实验一:为探究反应物浓度对化学反应速率的影响,设计的实验方案如下表。
(已知I2+2S2O![]() ==S4O
==S4O![]() +2I- ,其中Na2S2O3溶液均足量,且S2O
+2I- ,其中Na2S2O3溶液均足量,且S2O![]() 与S4O
与S4O![]() 均为无色)
均为无色)
实验序号 | 体积V/mL | 蓝色褪去时间/s | |||
Na2S2O3溶液 | 淀粉溶液 | 碘水 | 水 | ||
① | 10.0 | 2.0 | 4.0 | 0.0 | t1 |
② | 8.0 | 2.0 | 4.0 | 2.0 | t2 |
③ | 6.0 | 2.0 | 4.0 | Vx | t3 |
(1)表中Vx=_________mL,t1、t2、t3的大小关系是___________________
实验二:取5 mL 0.1 mol·L-1的KI溶液于试管中,滴加0.1 mol·L-1 FeCl3溶液2 mL,发生如下反应:2Fe3++2I-=2Fe2+ +I2,为证明该反应存在一定的限度,他们设计了如下实验:
①取少量反应液,滴加AgNO3溶液,发现有少量黄色沉淀(AgI)。
②再取少量反应液,滴加少量CCl4 ,振荡,发现CCl4层显浅紫色。
根据①②的现象,/span>他们得出结论:该反应具有一定的可逆性,在一定条件下会达到反应限度。
(2)指导老师指出上述实验①不合理,其原因是_______________ ; 你的改进方案是________(简要写出操作、试剂和现象)。
(3)实验②适合检验生成I2较多的情况,还有一种简便的方法可以灵敏地检验是否生成了I2,这种方法所用的试剂是_______________________。